Таутомерия гетероароматических соединений
Определение "Таутомерия гетероароматических соединений" в ЭБНБ
Многие гетероароматические соединения могут существовать в двух или более таутомерных формах. Если в качестве альтернативных мест протонирования выступают два гетероатома, в растворе обычно устанавливается равновесие, обусловленное быстрым внутримолекулярным переносом протона между кольцевым атомом азота и атомом азота, кислорода или серы заместителя, как показано на рис. 1 для 2- и 4-замещенных пиридинов.
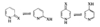
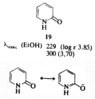
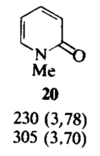
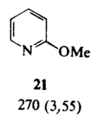
Эти равновесия особенно важны для производных пиримидина и пурина, так как эти гетероциклы входят в состав нуклеиновых кислот. Если один из таутомеров преобладает в растворе, его строение можно установить сравнением ИК-, УФ- и ЯМР-спектров со спектрами подходящих алкилированных производных. Например, УФ-спектр пиридона-2 (Рис 2) очень похож на спектр 1-метилпиридона-2 (Рис 3) в различных растворителях, но существенно отличается от спектра 2-метоксипиридина (Рис 4). Таким образом, можно сделать вывод, что равновесие между пиридоном-2 и 2-гидроксипиридином сильно сдвинуто в сторону первого (соотношение 9:1).
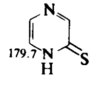
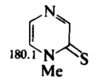
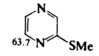
Соответствующие тионы (X=S) в растворе также предпочтительно существуют в таутомерных формах, показанных слева на Рис. 1, а аминопиридины (X = NH) — в формах, расположенных справа. Такие же таутомеры преобладают в растворах других производных шестичленных гетероароматических соединений. Например, пиразинтион-2 (Рис 5) существует в растворе главным образом (около 97%) в показанной на схеме таутомерной форме. Это установлено сравнением его спектра ЯМР с таковыми для N-метилпроизводного (Рис 6) и S-метилпроизводного (Рис 7). 15N-ЯМР служит очень хорошим методом для определения положений таких равновесий. Химические сдвиги для 15N (по отношению к CD3NO2) приведены ниже для атомов N-1 в трех гетероциклах в растворе ДМСО-D6.
На положения этих прототропных равновесий можно повлиять, изменив природу растворителя или концентрацию раствора. Показано, что для системы 2-гидроксипиридин — пиридон-2 в очень разбавленном растворе (10 моль/л) или в газовой фазе преобладает гидрокси-форма. Пиридон-2 в неполярных растворителях ассоциируется, образуя связанный водородной связью димер, и эта форма оказывается более стабильной, чем мономер, вследствие чего она преобладает в неполярных растворителях при средних концентрациях. Для пиридона-4 невозможно предотвратить процесс ассоциации, даже при очень низких концентрациях, поэтому нельзя определить истинное положение равновесия для мономерной формы. Однако гидрокси-форма, по-видимому, наиболее стабильна в газовой фазе. Полярные растворители могут влиять на положение равновесия, что обусловлено различной специфической сольватацией таутомеров: таутомеры обычно отличаются по полярности и по способности образовывать водородные связи с растворителями. Таким образом, только проводя исследования в газовой фазе, можно получить истинную информацию об отличиях в энергиях химических связей таутомеров.
Различия, в частности, обусловлены разницей в степени ароматичности таутомеров. Например, в системе 2-гидроксипиридин — пиридон-2 первый таутомер — явно ароматическое соединение с 6π-злектронной системой. Пиридон-2 также сохраняет в значительной степени ароматический характер, поскольку представляет собой циклическую систему π-связей с шестью р-орбиталями.
Разница в эмпирических энергиях резонанса метилированных аналогов 20 и 21 была оценена в 6,5 ккал/моль (27 кДж/моль), что составляет около 20% эмпирической энергии резонанса бензола; следовательно, 1-метилпиридон-2 имеет значительную энергию резонанса. На основе изучения влияния характера среды на положение равновесия становится ясно, что относительная ароматичность различных таутомеров не влияет на то, какая форма преобладает в растворе. Это, в основном, определяется концентрацией раствора и природой растворителя. Химические реакции смеси таутомеров не связаны с тем, какая структура преобладает, особенно если перенос протона происходит достаточно быстро.
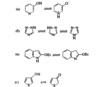
В гетероароматических соединениях встречаются некоторые другие типы прототропной таутомерии, примеры приведены на рис. 8. Для 3-гидроксипиридина в растворе устанавливается равновесие с оксидом пиридиния (рис. 8, а), так как не существует нейтрального таутомера «пиридона». Внутримолекулярные таутомерные переходы в полностью ароматических структурах, связанные с протонированием и депротонированием различных кольцевых атомов азота, как, например, в молекуле 1,2,4-триазола (рис. 8, б), обычно представляют собой быстрые низкоэнергетические процессы. В противоположность этому, при протонировании и депротонировании по атому углерода требуется значительная энергия активации; таутомеры, представленные на рис. 8, в, могут быть выделены в индивидуальном состоянии. Даже енольные таутомеры замешенных пятичленных гетероциклов, показанные на рис. 8, г, могут быть генерированы и охарактеризованы в растворе, хотя они нестабильны. 3-Гидрокситиофен (X=S) выступает в качестве преобладающей формы в условиях равновесия, тогда как фуран (Х=O) быстро таутомеризуется в более стабильную кето-форму. Кето-формы соответствующих пирролов (X=NR) так-же более стабильны.
При обсуждении в последующих главах таутомеры гетероароматических соедиений будут изображаться и называться в cooтветствии со структурой преобладающей в растворе формы.
Статья про "Таутомерия гетероароматических соединений" в Энциклопедии БНБ была прочитана 7797 раз
|