Шестичленные ароматические гетероциклы
Определение "Шестичленные ароматические гетероциклы" в ЭБНБ
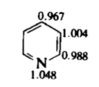
Все шестичленные полностью ненасыщенные гетероциклические соединения можно представить как бензол, у которого один или более атомов углерода заменены на гетероатом. Пиридин (азабензол) — простейший из подобных соединений — имеет один кольцевой атом азота. Подобно бензолу, молекула пиридина представляет собой плоскую циклическую систему, слегка искаженный шестиугольник из-за меньшей длины связи С—N по сравнению со связями С—С. Ее можно представить (рис. 1, а) как циклическую систему, состоящую из пяти sp2-гибридизованных атомов углерода, к каждому из которых присоединен атом водорода (на рисунке не показаны), и одного sp2-гибридизованного атома азота. Каждый из шести атомов кольца имеет одну р-орбиталь, перпендикулярную плоскости кольца. Эта структура подобна структуре бензола по наличию единого цикла р-орбиталей, содержащего шесть электронов, но отличается тем, что обладает неподеленной парой электронов в плоскости кольца. Подобно бензолу, молекулу пиридина удобно представить в виде одной из двух эквивалентных структур Кекуле.
Для интерпретации структуры бензола, пиридина и родственных им циклических органических соединений широко используют теорию молекулярных орбиталей. В приближении Хюккеля электроны р-орбиталей рассматривают отдельно от электронов, которые образуют связи в плоскости кольца. Шесть р-орбиталей объединяются с образованием шести делокализованных π-молекулярных орбиталей, каждая из которых содержит максимум два электрона. Расчеты энергий этих орбиталей позволили сделать вывод о том, что три из них обладают более низкой энергией, чем изолированные р-орбитали, а три — более высокой. Три низкоэнергетические связывающие π-орбитали способны принять шесть электронов, оставляя вакантными три высокоэнергетические разрыхляющие π-орбитали. Согласно правилу Хюккеля, основанному на расчетах простых молекулярных орбиталей, плоские молекулы с полным и неразрывным циклом р-орбиталей стабилизированы по сравнению с ациклическими аналогами, если они содержат (4n + 2)π-электронов, где я равно нулю или целому числу. Таким образом, бензол, пиридин и другие соединения с шестью π-электронами подчиняются правилу Хюккеля для n = 1. Они составляют наиболее многочисленную и важную группу структур, и их мы относим к «ароматическим».
π-Молекулярные орбитали бензола и пиридина представлены на рис. 2. На этих рисунках площади кружочков приблизительно соответствуют относительным орбитальным коэффициентам, а светлые и заштрихованные кружочки показывают противоположные фазы волновых функций. Орбитали пиридина качественно очень похожи на орбитали бензола, но существует два важных отличия. Первое состоит в том, что π-орбитали пиридина имеют более низкую энергию, что обусловлено большей электроотрицательностью атома азота по сравнению с углеродом. Второе отличие заключается в том, что, в то время как высшие занятые молекулярные орбитали (ВЗМО) бензола, орбитали π2 и π3, вырождены (т. е. равны по энергии), соответствующие орбитали пиридина имеют различные энергии. Орбиталь π2 со значительным коэффициентом на азоте ниже по энергии, чем орбиталь π3 с коэффицентами только на углероде, т. е. π3 — ВЗМО. Энергии ВЗМО имеют наибольшее значение, потому что, на их основе можно рассчитать химическую активность.
Альтернативную интерпретацию строения этих молекул дает теория валентных схем. Волновые функции молекул строятся из комбинации волновых функций составляющих атомов или фрагментов. Структуры бензола и ему подобных молекул описываются как «гибрид» нескольких классических связанных структур, называемых каноническими формами. Химики-органики считают эту теорию менее полезной, чем теория молекулярных орбиталей, так как числовые результаты, которые она дает для описания физических свойств, хуже, чем полученные с помощью метода молекулярных орбиталей. Однако эта теория имеет большие заслуги в обеспечении теоретической основы для структурного представления. Например, пиридин, изображенный на рис. 1, б, рассматривается как резонансный гибрид двух структур вместе с некоторыми другими менее важными. Расчеты, основанные на современных достижениях теории валентных схем, — так называемой теории «спин-связанных» валентных схем — обеспечивают гораздо более точную оценку физических свойств, чем прежде. Эта теория дает представление о строении бензола и пиридина иное, чем теория молекулярных орбиталей. Шесть электронов локализованы на шести перекрывающихся, перпендикулярных плоскости π-орбиталях, которые существенно искажают р-орбитали каждого кольцевого атома. Характерные свойства ароматических систем обусловлены симметричным взаимодействием электронных спинов в кольце. Эти расчеты показывают, что в случае пиридина две структуры Кекуле, изображенные на рис. 1, б, в результате этого взаимодействия преобладают и составляют 80% от общего взаимодействия спинов в молекуле. Теория оправдывает подобное изображение строения молекул и для других гетероциклических соединений.
Родство структур молекул бензола и пиридина распространяется также и на другие шестичленные сопряженные циклические системы, содержащие более одного атома азота в кольце. Известны восемь гетероциклических систем (включая пиридин), содержащих один или более sр2-гибридизованных атомов азота в цикле (рис. 3).
Пониженная π-электронная плотность на углеродных атомах кольца пиридина по сравнению с атомами углерода в бензоле, особенно в положениях 2 и 4, показана на рис. 4. По мере увеличения числа атомов азота в цикле понижение электронной плотности на атомах углерода становится более заметным. Поэтому ароматические гетероциклы такого типа часто относят к π-дефицитным гетероциклическим соединениям.
Азот — единственный элемент второго периода периодической системы, который может заменить группу СН в бензоле с образованием незаряженного ароматического гетероцикла. В случае кислорода образуется только положительно заряженная частица — катион пирилия. То же самое происходит и с участием атома серы. Однако другие элементы IV и V групп периодической системы могут образовывать незаряженные гетероциклические системы этого типа; некоторые примеры приведены на рис. 5.
Все эти циклические системы носят ароматический характер.
Статья про "Шестичленные ароматические гетероциклы" в Энциклопедии БНБ была прочитана 4873 раз
|