


БНБ
"ЭБНБ" (14252)
- Photogallery
- Естественные науки - Математика - Технология
- Авиация и машиностроение
- Высокие технологии
- Вычислительная техника
- Нанотехнология
- Роботехника
- Энергетика
- Электроника
Тиреотропный гормон
Определение "Тиреотропный гормон" в ЭБНБ
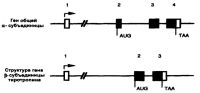 |
| Гены тиреотропного гормона человека |
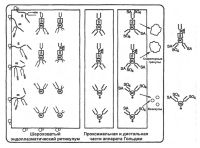 |
| Биосинтез тиреотропного гормона |
Хромосомная локализация и число генов, кодирующих синтез гликопротеиновых субъединиц некоторых гормонов
| Хромосома | ||
| Локализация | Число генов или псевдогенов | |
| Общая α-субъединица | 6 | 1 |
| β-субъединица хорионического гонадотропина | 19 | 7 |
| β-субъединица фолликулостимулирующего гормона | 11 | 2 |
| β-субъединица лютеинизирующего гормона | 19 | 1 |
| β-субъединица тиреотропного гормона | 1 | 1 |
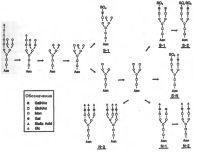 |
| Сульфатирование тиротропина |
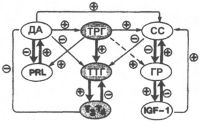 |
| Взаимодействия между модуляторами тиротрофов |
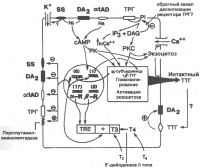 |
| Важные взаимодействия в тиротрофе |
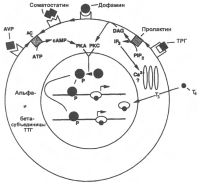 |
| Регулирование синтеза тиреотропного гормона |
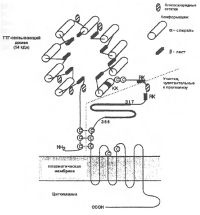 |
| Рецептор тиреотропного гормона |
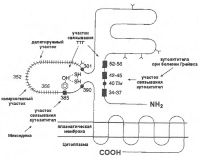 |
| Рецептор тиреотропного гормона |
Биогенные амины серотонин и дофамин могут ингибировать секрецию ТТГ гипофизом. Введение антител к серотонину увеличивает базальный уровень ТТГ и потенцирует ответную реакцию повышения уровня ТТГ на действие холода. Базальный уровень секреции тиротропина, равно как и уровень секреции, стимулируемый действием ТРГ, быстро уменьшается под влиянием дофамина и его агониста бромокриптина. Это является результатом быстрого (в течение нескольких десятков минут) торможения дофамином транскрипции генов обоих субъединиц ТТГ. Дофамин уменьшает внутриклеточный уровень цАМФ, от которого также зависит экспрессия генов, кодирующих синтез ТТГ.
Подобным, ингибирующим действием на базальную секрецию ТТГ и на секрецию, стимулируемую действием ТРГ, обладает также и соматостатин. Его ингибирующее действие более выражено при низких концентрациях тиреоидных гормонов.
Соматостатин может связываться в гипофизе и других структурах мозга с несколькими типами специфических, высокоаффинньх к нему рецепторов. При этом свое ингибирующее действие на секрецию ТТГ он может оказывать либо через систему циклических мононуклеотидов, либо вызывая гиперполяризацию мембраны тироцитов через изменение состояния потенциалзависимых калиевых каналов, что в конечном итоге ведет к снижению внутриклеточного уровня кальция.
Цитокины интерлейкин-1 (ИЛ-1) и в меньшей степени интерлейкин-6 (ИЛ-6) вызывают преходящее уменьшение содержания в плазме крови тиротропина и общих уровней тироксина и 3,5,3'-трийодтиронина, но увеличивают уровень свободного тироксина. Снижение в крови общего уровня тиреоидных гормонов является, как полагают, результатом прямого ингибирующего влияния этих цитокинов на функцию тиротрофов и ингибирующего действия на образование гормонов щитовидной железой. Кроме того, ингибирующее действие ИЛ-1 может быть также результатом его влияния на секрецию в гипоталамусе соматостатина или ТРГ.
Ингибирующим эффектом на секрецию тиреотропного гормона обладают норадреналин и глюкокортикостероиды, что может иметь отношение к регуляции уровня ТТГ и функции щитовидной железы при стрессе, а также к суточному ритму изменения уровня ТТГ. Острые или хронические заболевания также могут сопровождаться подавлением секреции ТТГ с последующим восстановлением при выздоровлении. Существование зависимости образования и секреции ТТГ от действия некоторых лекарственных средств, состояния стресса и наличия у человека соматических заболеваний должно учитываться врачом при интерпретации результатов исследования уровня тиротропина.
Тиротропин является основным регулятором функций тироцитов, действующим на большинство этапов синтеза, хранения и секреции тиреоидных гормонов. Пролиферация клеток, размер фолликулов и самой щитовидной железы также зависят от действия ТТГ.
Все эти эффекты являются результатом сложного комплекса биохимических и физико-химических реакций, которые протекают вслед за связыванием тиротропина с рецептором ТТГ, расположенным на базальной мембране тироцита и активацией связанной с G белком аденилатциклазы, а также активацией фосфатидилинозитольной системы фосфолипазой С.
Так как тиротропин-рецепторное взаимодействие является ключевым для влияния ТТГ на тиреоидные функции, то нарушение этого взаимодействия, например, при изменении структуры рецептора или его аффинности к ТТГ, может играть важную роль в патогенезе ряда заболеваний щитовидной железы. В частности, изменение структуры ТТГ рецептора в результате мутации гена, кодирующего его синтез, приводит к понижению или отсутствию чувствительности тироцитов к действию ТТГ и развитию врожденного первичного гипертиреоидизма.
Рецептор ТТГ был впервые выделен в 1986 году. Он оказался очень нестабильным при попытке его дальнейшей очистки и поэтому сведения о его структуре и свойствах получены косвенными методами исследования (кинетика связывания с тиротропином, моноклональными антителами и др.). В настоящее время осуществлено клонирование этого рецептора и установлена его первичная структура в виде гликопротеиновой цепи из 744 аминокислотных остатков.
Согласно модели трехмерной организации рецептора ТТГ, он относится к семейству 7-TMS (т.е. содержит в своей структуре 7 трансмембранных сегментов), ГТФ-зависимых, мембраносвязанных рецепторов, и состоит из трех структурных доменов: цитоплазматической, мембраносвязанной и внеклеточной (рис.).
Внутриклеточная часть представлена карбоксильным полипептидным сегментом, состоящим из 82 аминокислот; внутримембранная часть полипептидной цепи семь раз пронизывает плазматическую мембрану. Эта часть представляет собой β-субъединицу. Внеклеточная часть рецептора представлена гликозилированной полипептидной цепью, которая состоит из 397 аминокислот и является α-субъединицей рецептора.
Конформация внеклеточной части рецептора образуется тремя внеклеточными петлями (часть пептидной цепи с 366 по 317 аминокислотный остаток), которые являются продолжением мембраносвязанной части рецептора. Внеклеточный сегмент содержит, как полагают, основную часть мест связывания ТТГ, но в целом эффективность связывания ТТГ с рецептором сильно зависит от его трехмерной пространственной структуры.
Механизм внутриклеточной передачи сигнала и роль в этой передаче различных участков рецептора ТТГ пока точно не установлены, но очевидно, что внутриклеточной передаче сигнала предшествует этап связывания гормона с внеклеточной частью рецептора. Вероятно, что следствием этого связывания является изменение конформации внутримембранной части рецептора, которое ведет к взаимодействию цитоплазматического домена с G-белком. Диссоциация G-белка на Gap и Gy субъединицы ведет к образованию Gs-комплека, который, связываясь с аллостерическим центром аденилатциклазы, активирует образование цАМФ. цАМФ служит аллостерическим регулятором активности многих ферментов. В результате этих и ряда других сопряженных процессов активируются процессы поглощения тироцитами йодида, его транспорта и включения в структуру тиреоглобулина. В этих процессах важную роль играет также повышение внутриклеточной концентрации кальция.
Влияние ТТГ на транспорт йодид-иона является двухфазным. Вначале может наблюдаться потеря некоторой части йодида железой в результате усиленного гидролиза тиреоглобулина и повышения концентрации йодида в тироцитах. Затем выход йодида сменяется повышением его захвата тироцитами железы. Известно, что йод, поступивший в тироцит, для его включения в структуру тиреоглобулина должен быть активирован путем перевода в высокоэнергетическое состояние. Этот процесс осуществляется при участии фермента тиреопероксидазы, уровень мРНК которой возрастает под действием ТТГ. ТТГ быстро увеличивает активность НАД+-зависимой киназы и через активацию фосфолипазы С процессы гидролиза фосфатидилинозитола, что вместе с повышением уровня цАМФ ускоряет секрецию тиреоидных гормонов. Также увеличивается активность 5'-дейодиназы тироцитов щитовидной железы, способствующей сохранению высвобождающегося при ее участии йода в железе.
Под действием ТТГ активируются процессы образования псевдоподий, ускоряющих резорбцию тиреоглобулина из коллоида в тироциты, ускоряется образование в фолликулах коллоидных капель и гидролиз в них тиреоглобулина под действием лизосомапьных ферментов.
Параллельно активируется метаболизм тироцита, что сопровождается увеличением скорости поглощения тироцитами глюкозы, кислорода, окисления глюкозы и образования НАДФН2, необходимого для осуществления пероксидазной реакции. Усиление поглощения глюкозы под действием ТТГ достигается за счет индукции транскрипции гена переносчика глюкозы и усиления действия протеинкиназы А. ТТГ увеличивает также содержание цАМФ и экспрессию гена гексокиназы-1. Спустя несколько часов после введения ТТГ увеличивается синтез ДНК, мРНК, ускоряется синтез белков и фосфолипидов, которые необходимы для роста и увеличения числа тироцитов и образования фолликулов. Ускоряются синтез предшественников пуриновых и пиримидиновых оснований, активируются многие другие процессы каждого из этапов синтеза и секреции тиреоидных гормонов.
При длительном действии ТТГ на тироциты (более 2 часов) его эффекты могут ослабевать. Это явление получило название десенситизации рецепторов. Его причинами могут быть снижение чувствительности рецепторов, снижение их числа в мембраносвязанной форме, уменьшение аффинности к гормону или снижение эффективности процессов, следующих после связывания гормона с рецептором. Молекулярные механизмы десенситизации на сегодня остаются полностью неизвестными.
Уже упоминалось, что строение α-субъединиц ТТГ и гонадотропина одинаково. Возможно, что именно это структурное сходство является одной из причин того, что при высоких концентрациях гонадотропин может конкурировать за связывание с рецепторами ТТГ и через активацию фосфатидилинозитольного пути и увеличение активности аденилатциклазы стимулировать образование и секрецию тиреоидных гормонов щитовидной железой. Известны случаи тиреотоксикозов у больных с заболеваниями, сопровождающимися повышением уровня гонадотропина (например, при хорионэпителиоме).
Рецептор ТТГ способен связываться не только с тиротропином, но и с аутоантителами, стимулирующими этот рецептор. Такое связывание имеет место при аутоиммунном тиреоидите (болезни Грейвса). Источником этих антител являются β-лимфоциты сенсибилизированные к тироцитам. Аутоантитела известны также как тиреоид-стимулирующие иммуноглобулины. Они связываются с рецептором ТТГ и действуют на тироциты железы подобно тому, как это наблюдается при действии ТТГ. При этом продолжительность вызываемых действием антител эффектов значительно больше, чем при действии ТТГ.
Обнаружено также, что рецептор ТТГ способен связываться с аутоантителами, которые могут блокировать взаимодействие этого рецептора с ТТГ. Это может приводить к развитию атрофического тиреоидита, гипотиреоидизма и микседемы. При детальном изучении точной локализации мест связывания рецептором ТТГ, стимулирующих или блокирующих аутоантител оказалось, что эти места локализованы в различных участках внеклеточной части рецептора (рис.). Весьма вероятно, что локализация места связывания аутоантител на внеклеточном участке рецептора может иметь значение в клинических особенностях нарушений функции щитовидной железы.
Ген, кодирующий синтез рецептора ТТГ, расположен в коротком плече 14-й хромосомы (14q31). Известны случаи мутаций, сопровождавшихся аутоактивацией рецепторов и проявлявшихся клиническими формами гипертиреоидизма. При этом обнаруживалось нарушение структуры и свойств внутриклеточной части рецептора. Описаны также мутации, приводившие к нарушению структуры внеклеточной части рецептора и понижению его чувствительности к ТТГ. Это сопровождалось повышением уровня ТТГ в сыворотке крови при неизмененной функции щитовидной железы.
Результаты многих экспериментов на животных показывают, что почки являются одним из основных органов элиминации тиреотропного гормона из крови. При определении различий уровней радиоактивной метки в артериальной и венозной крови в разных органах (мышца голени, органы брюшной полости, почка, щитовидная железа) выявлено, что только почка экстрагирует и выводит из крови значительные количества тиротропина.
| "ЭБНБ" >> "Т" >> "ТИ" |
Статья про "Тиреотропный гормон" в Энциклопедии БНБ была прочитана 35977 раз
| Коптим скумбрию в коробке |
| Морской Гребешок в беконе |
TOP 15
- Вши и борьба с ними
- Пижма обыкновенная
- Каштан конский обыкновенный
- Роль элементов в жизни растений
- Пшеница
- Иван-чай узколистный
- Календула лекарственная
- Обеззараживание химическими средствами
- Клевер луговой
- Дезинфекция текущая
- Душица обыкновенная
- Бессмертник песчаный
- Как устроены растения
- Морфологические признаки почвы
- Хвощ полевой