


БНБ
"ЭБНБ" (14252)
- Photogallery
- Естественные науки - Математика - Технология
- Авиация и машиностроение
- Высокие технологии
- Вычислительная техника
- Нанотехнология
- Роботехника
- Энергетика
- Электроника
Секвенирование по сэнгеру больших днк праймерной прогулкой
Определение "Секвенирование по сэнгеру больших днк праймерной прогулкой" в ЭБНБ
 |
| Секвенирование фрагментов ДНК |
 |
| Секвенирование участков ДНК |
 |
| Амплификация участков ДНК, метод 1 |
 |
| Амплификация участков ДНК, метод 2 |
 |
| Стратегия секвенирования ДНК |
 |
| Стратегия секвенирования фрагментов ДНК |
 |
| Стратегия секвенирования рестриктазных фрагментов ДНК |
Был предложен еще один весьма продуктивный метод секвенирования неизвестных участков геномной ДНК, заключающийся в нескольких циклах линейной амплификации с помощью биотинилированного праймера, отжигающегося на участке ДНК с известной нуклеотидной последовательностью с таким расчетом, что при его ферментативном удлинении рост новосинтезируемой цепи ДНК будет направлен в область с неизвестной последовательностью нуклеотидов, интересующую исследователя [Lagerstrom et al, 1991; Nguyen et al., 1998]. На следующем этапе проводится сорбция этих биотинилированных цепей ДНК на магнитных частицах со стрептавидином и удаление остальной ДНК. Затем с помощью короткого олигонуклеотидного праймера с произвольно выбранной последовательностью и исходного биотинилированного осуществляется второй этап ПЦР, проводимый уже в условиях экспоненциальной амплификации (рис.). Поскольку короткий произвольный праймер имеет достаточно высокую вероятность отжечься на неизвестном участке ДНК, то в результате 25-30 новых циклов будет наработан фрагмент или фрагменты ДНК, которые можно будет отобрать по размеру. Однако, если подобный эксперимент проводить не с изолированными линейными амплификатами, содержащими участок с известной нуклеотидной последовательностью, но и в присутствии всей, не удаленной основной массы тотальной ДНК, то количество амплифицированных случайных фрагментов ДНК будет чрезмерно большим за счет значительного числа мест отжига таких коротких праймеров, что или сильно затруднит, или сделает невозможным поиск среди них целевого фрагмента.
Весьма интересен подход к секвенированию протяженных фрагментов ДНК, названный авторами не праймерной "прогулкой", а "прогулкой фрагментов" ДНК [Okano, Kambara, 1996]. Назван он так, видимо, потому, что удлиняемые на одном из первых этапов олигонуклеотидные праймеры и используемые затем в качестве затравки на завершающем ввиду их большой длины трудно назвать праймерами. Главной особенностью этого подхода можно считать крайне малую библиотеку предсинтезированных олигонуклеотидных праймеров, состоящую всего из 16 вариантов — 5'-TTTTTlTlTlTlTlTGCGNN-3'. 15 нуклеотидов этих праймеров формируют общую часть и представляют собой блок из дезокситимидинов, далее следуют три нуклеотида, комплементарных сайту узнавания (или, вернее, тому, что от него остается после расщепления ДНК) какой-либо рестрикционной эндонуклеазы (в рассматриваемой статье GCG и HhaI) и служащих в качестве позиционирующих нуклеотидов. Оставшиеся два нуклеотида (NN) принадлежат к варьирующей части и представляют собой все 16 возможных вариантов динуклеотидов АА, AC, AG, AT, CA, СС и т.д.
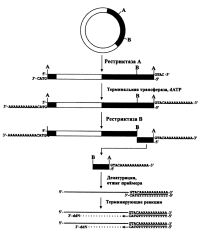
На первом этапе клонированный фрагмент ДНК расщепляется соответствующей рестрикционной эндонуклеазой (здесь — HhaI), образующей 3'-выступающий конец. Далее с помощью терминальной нуклеотидтрансферазы к полученным рестриктазным фрагментам "пришивается" блок поли(дА). После денатурации ДНК и отжига сразу всех возможных 16 праймеров идет построение цепи ДНК, приводящее к удлинению некоторых праймеров. За счет довольно протяженной общей части этих праймеров (TTTTTTTTTTTTTTTGCG) все они "отожгутся" на поли(дА)-последовательности, причем позиционирующие нуклеотиды (GCG) заставят их сделать это вплотную к концу рестриктазного фрагмента ДНК. Однако удлинение праймеров будет возможно только в том случае, если два последних вариабельных нуклеотида (NN) окажутся комплементарными присутствующим в самой матрице ДНК (при использовании ДНК-полимеразы с отсутствующей или удаленной 3' → 5'-редактирующей активностью). Таким образом, на данном этапе происходит как некоторая селекция праймеров, так и их удлинение. На следующем этапе осуществляется непосредственно само секвенирование ДНК путем построения новых цепей ДНК в условиях терминирования дидезоксинуклеотид трифосфатами. Матрицами служат как повторно денатурированные фрагменты ДНК из предыдущей реакции удлинения праймера, так и вновь добавленный исходный клонированный фрагмент ДНК, не подвергнутый расщеплению рестрикционной эндонуклеазой (здесь - HhaI). В результате одновременно протекает две секвенирующие реакции. Одна из них использует выбранный какой-то конкретный 5'-TTTTTTTTTTTTTTTGCGNN-3' праймер, отжигающий на матрице в виде рестриктазного фрагмента ДНК, другая - удлиненный праймер, или, правильнее сказать, "фрагмент-праймер", отжигающийся уже своей удлиненной частью на нерасщепленном исходном фрагменте ДНК. Эта стадия проходит в режиме циклического секвенирования и в результате оказывается возможным "чтение" обоих продуктов секвенирующих реакций. Следует отметить, во-первых, некоторую конкуренцию "фрагмента-праймера" и комплементарной ему цепи рестриктазного фрагмента на этапе отжига перед секвенирующими реакциями, и, во-вторых, определенные сложности в выборе того или иного праймера из 16 возможных (описание данного процесса нами просто опущено). Из представленной (упрощенной) схемы на рис. можно оценить всю сложность и трудоемкость данного подхода. Однако этот метод возник не неожиданно и явился продолжением предыдущих работ этой группы. Ранее в модельном эксперименте с HindIII-фрагментами ДНК фага лямбда эти авторы продемонстрировали успешное применение данного подхода без построения поли(дА)-конца [Furuyama et al., 1994].
Стратегия секвенирования рестриктазных фрагментов ДНК, расщепленных ферментами, образующими 3'-выступающие концы, путем "пришивания" к последним поли(дА)блока, приведенная на рис., известна давно [Stallard et al., 1987]. В цитируемой работе для проведения терминирующих реакций рестриктазные фрагменты ДНК расщеплялись соответствующими ферментами (здесь - КрпI или PstI) и после присоединения к ним участка поли(дА) с помощью терминальной трансферазы расщеплялись другой подходящей рестрикционной эндо-нуклеазой, разделялись электрофорезом и элюировались из геля. 20-звенные праймеры, кроме 16 дТ-остатков, в качестве позиционирующих нуклеотидов содержали элементы сайтов узнавания GTAC и TGCA, использованных для расщепления ферментов КрпI или PstI соответственно. После отжига KpnI- или PstI-праймера на элюированной из геля и денатурированной матрице проводились терминирующие реакции и продукты разделялись секвенирующим гель-электрофорезом.
Другой разновидностью праймерной "прогулки" является стратегия секвенирования протяженных фрагментов ДНК ферментативным методом по Сэнгеру с помощью сплинкера - секвенирующего праймер-линкера (рис.). Одно из основных отличий этого способа секвенирования ДНК от подхода праймерной "прогулкой" заключается в довольно ограниченном числе олигонуклеотидных праймеров, необходимых для его осуществления. Было найдено весьма интересное решение по объединению в одной молекуле праймера и линкера, получившего название сплинкер (splinker - sequencing primer linker) [Kalisch et al., 1986]. Особенностью такого сплинкера было то, что его последовательность содержала внутренний участок гомологии, что при определенной температуре приводило к формированию вторичной структуры в виде "шпильки" с выступающим или тупым концами. За счет этих выступающих или тупых концов осуществлялось лигирование данного конкретного сплинкера с элюированным из геля рестриктазным фрагментом ДНК, имеющем аналогичные концы. Таким образом, основная последовательность самого сплинкера могла быть практически одинаковой и отличаться только своими концевыми нуклеотидами, выбор вариантов которых довольно ограничен.
Для осуществления этой стратегии секвенирования требуется некоторая предварительная подготовка как самого сплинкера, так и рестриктазного фрагмента ДНК. Для того чтобы сплинкер мог служить в качестве затравочной молекулы для элюированного из геля рестриктазного фрагмента, на его 5'-конец необходимо с помощью полинуклеотидкиназы фага Т4 в присутствии АТФ добавить остаток фосфорной кислоты. А рестриктазный фрагмент ДНК, напротив, надо дефосфорилировать обраткой щелочной фосфатазой. В результате этих процедур после лигирования сплинкера с данным рестриктазным фрагментом, как можно видеть из рис., образуется "ник", приводящий после денатурации цепей ДНК к формированию затравки для синтеза новой комплементарной цепи ДНК в условиях терминации с дидезоксинуклеотидтрифосфатами. Перед нанесением продуктов терминирующих реакций на секвенирующий гель-электрофорез необходим этап их расщепления рестрикционной эндонуклеазой, сайт которой имеется в сплинкере, поскольку, как отмечалось выше, необходимым элементом сплинкера является наличие в его двуцепочечном участке доступного сайта узнавания относительно редкощепящей рестрикционной эндонуклеазы, расщепление которого позволяет удалить концевую петлю сплинкера. Такое расщепление обеспечивает образование гомогенного 5'-конца для смеси терминированных фрагментов ДНК. Следует отметить, что при этом способе секвенирования ДНК метка не может находиться на 5'-конце праймера и должна включаться в ходе проведения терминирующих реакций.
Еще ряд подходов, описываемых ниже, хотя и не принадлежат к классическим вариантам праймерной "прогулки", все же основаны на использовании олигонуклеотидных праймеров. Вторым важным условием их осуществления является применение ПЦР. Так, был предложен интересный способ получения однонаправленных делеционных вариантов клонированной вставки с помощью ПЦР и биотинилированного праймера [Yohda et al., 1995]. Амплифицированный с использованием фланкирующих его праймеров (один из которых нес биотинилированную метку) фрагмент ДНК был затем расщеплен тетрануклеотидной рестрикционной эндонуклеазой в условиях недорестрикции. Далее следовал этап лигирования полученных фрагментов со специальным линкером, в результате чего образовывалась смесь разнообразных фрагментов, среди которых присутствовали как ограниченные по обеим концам только линкерами, так и варианты с участием линкера и того или иного праймера. Добавление в реакционную смесь магнитных частиц, покрытых стрептавидином, позволяло сорбировать на них только ограниченные биотинилированным праймером, тогда как прочие исключались из дальнейшего обращения. В результате повторного этапа ПЦР с данным биотинилированным праймером и праймером, гомологичным линкеру, происходила амплификация однонаправленных делеционных вариантов вставки, после разделения гель-электрофорезом которых они становились пригодны для секвенирования. Несколько похожий метод, также основанный на частичном расщеплении амплификатов тетрануклеотидной рестрикционной эндонуклеазой в условиях недорестрикции, описывается в другой работе [Wright, 1992]. Главное отличие этого подхода состояло в неиспользовании магнитных частиц и биотинилированного праймера. Другими авторами аналогичное частичное расщепление фрагмента ДНК достигалось за счет произвольного включения во время ПЦР метилированных производных цитозина, что защищало фрагмент ДНК от действия ферментов, чувствительных к метилированию цитозиновых остатков [Wong et al., 1997].
Секвенирование ДНК с помощью произвольных праймеров стало возможным благодаря предложенному методу, названному авторами SWAPP (Sequencing With Arbitrary Primer Pairs) [Burt et al., 1994]. Однако подобный подход малопригоден для крупномасштабного секвенирования ДНК и может применяться лишь для определения нуклеотидных последовательностей произвольных фрагментов ДНК у близкородственных организмов с целью выявления полиморфизма каких-то их генов или прочих фрагментов ДНК. Главным условием для успешного осуществления этого метода является секвенирование амплификатов, ограниченных обязательно разными праймерами. Иначе в противном случае необходимо проводить деление цепей, что весьма трудоемко и сразу снижает ценность метода. Выявление амплификата, пригодного для секвенирования, проводится путем сравнения 3 электрофоретических картин результатов ПЦР, в которых использовались оба праймера вместе и поодиночке. Полосы, видимые только при совместном применении праймеров и совпадающие у разных образцов ДНК по размеру (что косвенно может свидетельствовать об их принадлежности к сходным участкам генома у близкородственных видов), элюировались из геля и брались для дальнейшего секвенирования с использованием в качестве затравки при проведении уже терминирующих реакций одного из амплификационных праймеров.
Неким вариантом секвенирования ДНК с помощью "прогулки" праймерами можно считать "мультипраймерное" секвенирование, где в качестве затравочных молекул служат обе цепи подходящих рестриктазных фрагментов ДНК вставки [Akiyama et al., 1992]. Поскольку построение комплементарных цепей ДНК в данной работе в условиях терминации осуществлялось в присутствии деазапроизводных дГТФ и дАТФ, то у авторов после завершения реакций появилась возможность удаления служащего праймером рестриктазного фрагмента за счет восстанавливаемого сайта используемой рестрикционной эндонуклеазы без опасения расщепить новосинтезированную цепь ДНК, несущую модифицированные нуклеотиды, что позволило увеличить число "читаемых" нуклеотидов.
| "ЭБНБ" >> "С" >> "СЕ" >> "СЕК" |
Статья про "Секвенирование по сэнгеру больших днк праймерной прогулкой" в Энциклопедии БНБ была прочитана 4943 раз
| Коптим скумбрию в коробке |
| Каша со столетними яйцами |
TOP 15
- Вши и борьба с ними
- Пижма обыкновенная
- Каштан конский обыкновенный
- Роль элементов в жизни растений
- Пшеница
- Иван-чай узколистный
- Календула лекарственная
- Обеззараживание химическими средствами
- Клевер луговой
- Дезинфекция текущая
- Душица обыкновенная
- Бессмертник песчаный
- Как устроены растения
- Морфологические признаки почвы
- Хвощ полевой