


БНБ
"ЭБНБ" (14252)
- Photogallery
- Естественные науки - Математика - Технология
- Авиация и машиностроение
- Высокие технологии
- Вычислительная техника
- Нанотехнология
- Роботехника
- Энергетика
- Электроника
Подготовка фрагментов днк по максаму-гилберту
Определение "Подготовка фрагментов днк по максаму-гилберту" в ЭБНБ
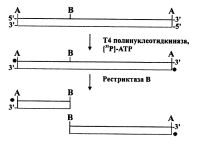 |
| Фрагменты ДНК, меченных по одному концу |
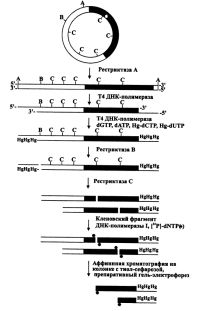 |
| Фрагменты ДНК, меченных фракционированием |
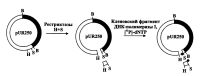 |
| Фрагменты ДНК, меченных после клонирования |
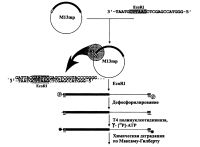 |
| Фрагменты ДНК, на основе фага М13 |
Как уже отмечалось, получение фрагментов ДНК, несущих только один меченый 3'-конец, возможно также путем асимметричного (здесь - генерирующего фрагменты разной длины) расщепления соответствующей рестрикционной эндонуклеазой и последующего препаративного электрофореза, как и в случае фрагментов ДНК с мечеными 5'-концами. Однако более привлекательным является подход, основанный на знании рестриктазной карты всего клонированного фрагмента ДНК и разработанной стратегии секвенирования, позволяющей в результате препаративного расщепления разными рестрикционными эндонуклеазами и препаративного электрофореза получить целый набор фрагментов ДНК, несущих разные концы, как 5'-, так и У -выступающие, причем в случае обоих 5'-выступающих концов у одного фрагмента ДНК они могут иметь отличающиеся последовательности. Например, фрагменты ДНК, образованные совместным расщеплением двух рестрикционных эндонуклеаз НindIII и SalI, будут иметь 5'-AGCT-3' и 5'-TCGA-3' выступающие концы соответственно. Так, для их мечения Кленовским фрагментом ДНК-полимеразы I будут необходимы комплементарные первым нуклеотидам в выступающем одноцепочечном участке предшественники дАТФ и ТТФ соответственно. Добавляя в реакционную смесь тот или иной дНТФ, можно избирательно метить требуемые концы и получать меченые фрагменты, непосредственно пригодные для секвенирования разных цепей одного и того же фрагмента ДНК и не требующие дополнительных этапов рестриктазного расщепления и электрофореза. Вся подготовка таких фрагментов к проведению реакций химической модификации будет заключаться в осаждении ДНК этанолом с целью удаления как не включившейся радиоактивной метки, так и солей, о чем более подробно речь пойдет в следующем разделе.
Был предложен интересный, хотя и весьма трудоемкий, способ получения меченных по одному концу фрагментов ДНК, заключающийся в их разделении аффинной хроматографией на колонках с тиол-сефарозой [Hartley et al., 1982]. Схема получения таких фрагментов, приведенная на рис. 1.3, состоит в следующем. Первым этапом является линеризация вектора со вставкой путем расщепления одной из рестрикционных эндонуклеаз, сайт узнавания которой расположен в последовательности вектора. Второй этап, состоящий как бы из двух стадий, необходим сначала для удаления 100-200 нуклеотидов с обоих 3'-концов противоположных цепей ДНК, осуществляемого при помощи 3' → 5'-экзонуклеазной активности ДНК-полимеразы фаза Т4 в отсутствие в реакционной смеси дНТФ и затем достраивания удаленных нуклеотидов за счет полимеразной активности этого же фермента после добавления в реакционную смесь дНТФ, часть из которых несла в 5'-положении пиримидиновых оснований атом ртути. На третьем этапе проводилось еще одно расщепление вектора подходящим ферментом, в результате чего образовывались два фрагмента, каждый из которых нес на своем 3'-конце ртутную метку. Четвертый этап заключался в частичном расщеплении в условиях недорестрикции уже самой вставки частощепящей рестрикционной эндонуклеазой. На пятом этапе осуществлялось мечение 3'-концов, генерируемых этой частощепящей рестрикционной эндонуклеазой с помощью Кленовского фрагмента ДНК-полимеразы I и соответствующего меченого (32Р) дНТФ. После разделения на следующем этапе продуктов всех этих реакций с помощью аффинной хроматографии на колонке с тиол-сефарозой с последней элюировалась фракция ртутьсодержащих фрагментов ДНК, меченных радионуклидом по одному концу. Далее следовал этап электрофоретического разделения полученных меченых фрагментов ДНК уже по размеру для проведения затем с ними реакций химической модификации. Даже простое описание всего этого процесса позволяет оценить всю его трудоемкость, поэтому создание специализированных векторов для секвенирования ДНК позволило исключить трудоемкий этап препаративного электрофореза и получать меченые по одному концу фрагменты ДНК сразу после расщепления двумя рестрикционными эндонуклеазами и мечения Кленовским фрагментом ДНК полимеразы I.
Третье поколение плазмидных векторов общего назначения в числе новых черт несло синтетический участок ДНК, называемый полилинкером. Создание полилинкера оказало значительное влияние на развитие стратегии секвенирования ДНК методом химической деградации в целом [Ruther et al., 1981; Ruther, 1982]. Не менее важна его роль в получении фрагментов ДНК, меченных по одному из 3'-концов, Рис. наглядно иллюстрирует возможность получения меченых фрагментов ДНК, пригодных для секвенирования, не прибегая к этапу препаративного гель-электрофореза, обычно трудоемкого и приводящего к значительным потерям меченого препарата ДНК.
В результате расщепления рекомбинантной плазмиды, несущей вставку, например по сайту узнавания рестрикционной эндонуклеазы ВатHI, уже упомянутыми выше рестрикционными эндонуклеазами HindIII и SalI, генерирующими выступающие концы 5'-AGCT-3' и 5'-TCGA-3' соответственно, образуется два фрагмента ДНК. Один из этих фрагментов будет содержать всю вставку и почти весь вектор, а второй - только небольшой участок полилинкера, ограниченный сайтами рестрикционных эндонуклеаз HindIII и SalI. После этапа мечения с помощью 32Р дТТФ и Кленовского фрагмента ДНК-полимеразы I концов, образованных рестрикционной эндонуклеазой SalI, в реакционной смеси будут присутствовать два меченых фрагмента ДНК, резко различающиеся по своей длине. Ввиду того, что HindIII-SalI-участок полилинкера имеет протяженность всего 18 пн, то нет особой надобности в проведении препаративного электрофореза с целью элюции основного фрагмента ДНК, предназначенного для секвенирования. Некоторым недостатком данного подхода является то, что при "чтении" радиоавтографа секвенирующего геля из-за наложения полос двух секвенируемых фрагментов ДНК (вставки с основной частью вектора и участка полилинкера) первые нуклеотиды вставки, соответствующие длине меченого фрагмента полилинкера (в данном случае 18), или не будут читаться совсем, или придется принимать во внимание последовательность этого участка заодно секвенируемого полилинкера. С уверенностью можно сказать лишь то, что, по крайней мере, один нуклеотид вставки, соответствующий по размеру данному участку полилинкера, будет невозможно идентифицировать, поскольку, скорее всего, при проведении реакций химической деградации некоторое количество исходного меченого фрагмента полилинкера все же останется и даст на всех дорожках сигналы обычно более интенсивные, чем принадлежащие остальным расщепленным фрагментам ДНК. Справедливости ради следует отметить, что подобный подход был применен ранее еще с вектором pBR322, не имеющим полилинкера, но несущим сайты узнавания рестрикционных эндонуклеаз HindIII и ClaI, расположенных на расстоянии всего 29 и 23 пн от сайта рестрикционной эндонуклеазы ЕсоRI соответственно [Frischauf et al., 1980].
Однако такое наложение полос двух секвенируемых фрагментов не представляет серьезного неудобства. С развитием методов секвенирования протяженных фрагментов ДНК стало ясно, что в каждом эксперименте читать начальные нуклеотиды часто не обязательно и их выявление обычно происходит при осуществлении перекрытия с другими фрагментами ДНК. Более того, рестрикционные эндонуклеазы для расщепления и последующего мечения концов, образованных одной из них, стараются подбирать так, чтобы выщепляемый фрагмент полилинкера был бы минимально возможным, принимая во внимание возможность рестрикции ДНК отдельными ферментами, поскольку для различных рестрикционных эндонуклеаз существуют свои определенные требования к локализации места узнавания на определенном расстоянии от края фрагмента ДНК для эффективного расщепления. Некоторая опасность в виде неполного расщепления рекомбинантной плазмиды одной или сразу двумя рестрикционными эндонуклеазами все же подстерегает экспериментаторов. Поскольку разница в размерах линеаризованной вставки с полноразмерным вектором и с вектором без небольшого участка полилинкера крайне незначительна, то проверить полноту расщепления ДНК обоими ферментами с помощью аналитического гель-электрофореза очень трудно. В этом случае (недорасщепления второй рестрикционной эндонуклеазой в дистальной части полилинкера) наложение полос может быть на всем протяжении секвенируемого фрагмента ДНК, что сведет на нет все предыдущие усилия. Избежать этого можно, проводя последовательные расщепления двумя ферментами. Причем сначала надо использовать второй фермент (в нашем примере HindIII), расположенный дальше от места клонирования вставки, проверить полноту расщепления аналитическим гель-электрофорезом и только затем добавить первый фермент, по сайту которого и будет осуществляться мечение. Заранее зная, что этот фермент работает в таком буфере и данная фасовка содержит работающий фермент, можно не проводить дополнительную стадию гель-электрофореза (тем более, что в ней мало что можно будет увидеть нового, если не прилагать значительных усилий) и сразу осуществить этап мечения Кленовским фрагментом ДНК-полимеразы I. Конечно, можно попытаться увидеть появляющийся небольшой фрагмент ДНК, принадлежащий полилинкеру в высокопроцентном агарозном геле или даже полиакриламидном, но все это весьма трудоемко и, более того, надо обязательно обработать препарат ДНК РНКазой, поскольку в противном случае тРНК и обломки прочих РНК будут маскировать маленький фрагмент ДНК полилинкера. Таким образом, лучше не проводить столь сложных процедур отчасти из-за того, что если вторая рестрикционная эндонуклеаза в этом способе даже не полностью расщепила свой сайт, часть образованных концов будет все же доступна для мечения и этого количества может оказаться достаточно для проведения секвенирования данного фрагмента ДНК. Единственное, что остается порекомендовать в подобной ситуации - это полагаться на свой собственный опыт.
Дальнейшее совершенствование плазмидных векторов для секвенирования ДНК позволило создать еще более удобные специальные полилинкеры, содержащие в своей последовательности два участка расщепления рестрикционной эндонуклеазы Thtl 1II, имеющей сайт узнавания GACN^NNGTC [Eckert, 1987; Volckaert, 1987]. Уникальность этой рестрикционной эндонуклеазы применительно к получению меченых фрагментов ДНК, пригодных для секвенирования, заключается в следующем. В результате расщепления ДНК этим ферментом образуются фрагменты ДНК с одним выступающим нуклеотидом на 5'-конце, пригодные для мечения Кленовским фрагментом ДНК-полимеразы I. Сайт узнавания этого фермента представляет собой прерванный гексануклеотидный палиндром, центральные нуклеотиды которого могут быть любыми. Поскольку в описываемых полилинкерах векторов pSP64CS, pSP65CS и pGV451 центральные нуклеотиды в одном случае были G и Т, а в другом А и С, то при мечении Кленовским фрагментом ДНК-полимеразы I при добавлении какого-либо одного дНТФ метится только один 3'-конец из четырех возможных. Таким образом, отпадает необходимость расщепления полилинкера вектора вторым ферментом и, более того, секвенируемый фрагмент, теоретически, может "читаться" с первого нуклеотида.
В литературе описан интересный способ получения меченного по одному концу одноцепочечного фрагмента ДНК, клонированного в каком-либо из фаговых векторов серии M13mp [Bellemare et al., 1986]. Его суть заключается в отжиге специального олигонуклеотида на комплементарном ему участке одноцепочечной векторной молекулы, прилегающему к полилинкеру и захватывающему сайт подходящей полилинкерной рестрикционной эндонуклеазы (в рассматриваемом случае - ЕсоШ) и последующем расщеплении образовавшегося двуцепочечного участка данным ферментом (рис. 1.5). Что касается самой вставки, то даже в случае присутствия в ней последовательности, узнаваемой используемым ферментом, она не будет подвержена расщеплению, поскольку остается одноцепочечной. В результате линеаризации данного одно/двуцепочечного вектора, несущего вставку, образуется два 5' -выступающих конца, пригодных для их мечения полинуклеотидкиназой фага Т4 и радиоактивным у-АТФ после этапа дефосфорилирования. Таким образом, один радиоактивный 5'-конец будет принадлежать образовавшейся после расщепления части использованного олигонуклеотида, а другой - сайту использованной рестрикционной эндонуклеазы полилинкера, "продолжением" которого является клонированная вставка. Из-за большой разницы в размерах этих меченых фрагментов ДНК нет необходимости в проведении дополнительных этапов их разделения, что позволяет непосредственно после этапа мечения, предварительно удалив непрореагировавшую метку этанолом, проводить реакции химической модификации и пиперидинового гидролиза.
Другой способ получения меченного по одному концу фрагмента ДНК также на основе одноцепочечного фага М13 описан другими авторами [Rosenthal et al., 1990]. В данной работе осуществлялся отжиг меченого праймера на одноцепочечной матрице ДНК с таким расчетом, что построение комплементарной цепи с помощью высокопроцессивной ДНК-полимеразы приводило, в первую очередь, к копированию вставки, секвенирование которой и предполагалось.
С разработкой метода полимеразной цепной реакции (ПЦР) появилась еще одна возможность получения меченного по одному концу фрагмента ДНК. Так, если предварительно один из праймеров пометить с помощью полинуклеотидкиназы и меченного у-АТФ, то при амплификации нарабатываемый фрагмент ДНК будет нести метку на одном из 5'-концов [Ohara et al., 1989]. Однако при наличии нескольких различающихся продуктов ПЦР необходим этап повторной амплификации с выделенным из геля фрагментом ДНК, предназначенным для секвенирования. Естественно, в этом случае первая амплификация проводится с немеченными праймерами и только во время повторной -один из праймеров должен быть меченым. В то же время можно проводить реакции химической деградации с мечеными фрагментами ДНК, выделенными из геля, не прибегая к повторной амплификации [Tahara et al., 1990; Gal, 1996].
Существует и другая возможность получения с помощью ПЦР фрагмента ДНК, пригодного для мечения только по одному концу и ранее успешно реализованная [Nakamaye et al., 1988]. В этом случае амплификация проводится с праймерами, один из которых предварительно фосфорилирован. После завершения амплификации у конечного продукта ДНК на одном из 5' -концов, принадлежащему изначально нефосфорилированному праймеру, будет отсутствовать фосфатная группа и, таким образом, он будет пригодным для мечения радиоактивным γ-АТФ с помощью полинуклеотидкиназы фага Т4.
| "ЭБНБ" >> "П" >> "ПО" >> "ПОД" |
Статья про "Подготовка фрагментов днк по максаму-гилберту" в Энциклопедии БНБ была прочитана 4518 раз
| Бургер двойного помола |
| Куриный суп |
TOP 15
- Вши и борьба с ними
- Пижма обыкновенная
- Каштан конский обыкновенный
- Роль элементов в жизни растений
- Пшеница
- Иван-чай узколистный
- Календула лекарственная
- Обеззараживание химическими средствами
- Клевер луговой
- Дезинфекция текущая
- Душица обыкновенная
- Бессмертник песчаный
- Как устроены растения
- Хвощ полевой
- Морфологические признаки почвы