


БНБ
"ЭБНБ" (14252)
- Photogallery
- Естественные науки - Математика - Технология
- Авиация и машиностроение
- Высокие технологии
- Вычислительная техника
- Нанотехнология
- Роботехника
- Энергетика
- Электроника
Пиросеквенирование днк
Определение "Пиросеквенирование днк" в ЭБНБ
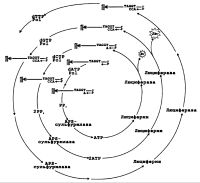 |
| Секвенирование ДНК ELIDA-методом |
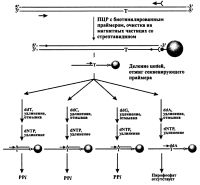 |
| Минисеквенирование ДНК |
(dNMP)n + dNTP → (dNMP)n+1 + РРi
АТФ-сульфурилаза
PPi + APS → ATP + SO2-4
Люцифераза
ATP + люциферин + O2 → AMP + PPi + оксилюциферин + CO2 + hv
где, (dNMP)n - ДНК, а п - число нуклеотидных остатков, PPi - неорганический пирофосфат, APS - аденозин 5'-фосфосульфат, hv - квант света.
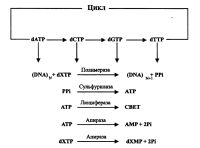 |
| Этапы пиросеквенирования ДНК |
В основе секвенирования ДНК, названной авторами ELIDA (Enzymatic Luminometric Inorganic pyrophosphate Detection Assay), лежит та же схема ферментативных реакций, предполагающая последовательные присоединения очередных дНТФ и детекцию высвобождающихся пирофосфатов. Затем неорганический пирофосфат под действием АТФ-сульфурилазы превращается в АТФ и уже молекулы АТФ детектируются с помощью люциферазы жука светлячка, однако было обнаружено, что замена дАТФ его тиопроизводным значительно снижает нежелательный фон, поскольку ДНК-полимераза способна использовать дАТФосБ в качестве субстрата, а люцифераза - нет [Ronaghi et al., 1996].
Как можно видеть из приведенной на рис. схемы секвенирования ДНК посредством понуклеотидного синтеза комплементарной цепи, правильнее говорить не о цикличном характере данного процесса, а скорее как о развивающемся по спирали. К такому выводу можно прийти ввиду того, что каждый (почти каждый) новый цикл начинается с молекулы ДНК, отличающейся от таковой в предыдущем цикле на один или более нуклеотидов.
Ранее этими же авторами был предложен несколько отличающийся подход, названный ими минисеквенированием (рис.) [Nyren et al., 1993]. Его особенностью было то, что на первом этапе в реакционной смеси присутствовали только ддНТФ, каждый в своей пробирке. Второй этап заключается в удлинении комплементарной цепи ДНК в тех пробирках, где не произошло включения ддНМФ. За счет этого достигалось значительное увеличение сигнала, поскольку при этом происходило включение сразу нескольких или даже многих дНМФ. Тип нуклеотида, находящегося в матрице сразу после праймера, определялся по тому, в какой из пробирок не происходило образование на второй стадии пирофосфата. В качестве контроля этого процесса вводились на первой стадии две дополнительные пробирки со всеми четырьмя ддНТФ одновременно и всеми дНТФ соответственно. Определив таким образом первый нуклеотид, приходилось готовить новые пробирки с добавлением в них этим же дНТФ, удлинять праймер и уже затем проводить опять все описанные выше процедуры по выявлению каких-либо трех невключенных в синтезируемую цепь ДНК ддНТФ.
Даже простое перечисление всех этих этапов само за себя говорит о невероятной громоздкости данной процедуры. В связи с этим авторы говорят о применении этого метода исключительно для выявления предполагаемых мутаций и единичных различий между разными образцами ДНК с заранее известной последовательностью. Более простой подход для выявления замен отдельных нуклеотидов, основанный также на детекции в режиме реального времени образовавшегося пирофосфата, был предложен ими позже [Nyren et al, 1997]. Суть его заключается в использовании двух праймеров, отличающихся своими дистальными нуклеотидами на 3'-конце, что позволяет наблюдать или не наблюдать удлинение цепи ДНК из-за образования или не образования спаренных нуклеотидов на 3'-конце праймера с матрицами ДНК соответственно. Главным условием правильного проведения этого процесса является использование ДНК-полимеразы, не обладающей 3' → 5'-экзонуклеазной редактирующей активностью, способной удалить неспаренные нуклеотиды, что привело бы к недостоверному результату.
В своих предыдущих работах эти авторы использовали в качестве ДНК-полимераз ферменты с отсутствием экзонуклеазных активностей - секвеназу, версия 2.0 и Кленовский фрагмент ДНК-полимеразы I, экзо-. Недавно они успешно применили эту технику и для РНК-зависимой ДНК-полимеразы - ревертазы вируса миелобластоза птиц [Karamohamed et al., 1998].
Однако наибольший интерес вызывает работа этих авторов, где ими сделаны существенные улучшения процесса секвенирования ДНК ELIDA-методом, что дало им основания и назвать новый подход пиросеквенированием ДНК [Ronaghi et al., 1998]. Так, в цитируемой работе в описанную выше схему было введено важное дополнение в виде нового фермента - апиразы, деградирующего нуклеотидтрифосфаты. Таким образом, в пиросеквенировании ДНК теперь задействовано 4 фермента (рис.). Роль первых трех известна, а апираза же позволяет автоматизировать этот процесс, удаляя между циклами избыток как образующихся в процессе реакции пирофосфоролиза молекул АТФ, не задействованных люциферазой, так и не включившихся в растущую цепь ДНК дНТФ. За счет этого не требуется проведения трудоемкого и отнимающего значительное время этапа промывки с целью удаления упомянутых выше нежелательных ингредиентов.
Авторы сообщают о созданном ими автоматическом инструменте для пиросеквенирования ДНК, позволяющем проводить одновременный анализ большого числа образцов с минимальным ручным трудом. К недостаткам метода можно отнести его не очень высокую производительность, а также некоторые трудности секвенирования гомополи-мерных участков, где происходит одновременное (в течение одного цикла) включение более чем одного одинакового дНМФ. Причиной последнего является непропорциональное увеличение свечения при включении подряд двух и более одинаковых нуклеотидов, однако, как считают сами авторы, специальная компьютерная программа могла бы в значительной мере снять эту проблему.
Справедливости ради следует отметить, что, основываясь на ранних работах этой группы авторов [Nyren, Lundin, 1985; Nyren, 1987], другим экспериментатором была предложена и осуществлена несколько отличающаяся схема секвенирования ДНК путем детекции пирофосфата в режиме реального времени [Hyman, 1988]. Одним из главных отличий было то, что в предложенном им способе реакции протекали не в растворе, а в стеклянном капилляре, представляющем собой одновременно хроматографическую колонку и реакционный сосуд, где ДНК и ферменты были иммобилизованы на трезил-сефарозе 4В. Другим новшеством было добавление к ДНК-полимеразе, АТФ-сульфурилазе и люци-феразе еще двух ферментов - глицерокиназы и гексокиназы, с помощью которых удалялось обычно всегда присутствующее в препаратах аденозинфосфосульфата загрязняющее количество АТФ путем превращения последнего в АДФ, что заметно снижало уровень "шумов". Модельный эксперимент по секвенированию поли(дА • дТ) позволил выявить ряд нюансов при использовании данного метода. Так, была показана линейная зависимость увеличения свечения при одновременном (за один этап) включении нескольких одинаковых нуклеотидов и соответственно увеличенной концентрации высвобождающегося при этом пирофосфата, но при относительно низком количестве иммобилизованной люциферазы. Отрицательным моментом такой линейности явилась более низкая чувствительность самого метода.
| "ЭБНБ" >> "П" >> "ПИ" |
Статья про "Пиросеквенирование днк" в Энциклопедии БНБ была прочитана 6953 раз
| Каракатица на гриле |
| Каракатица на гриле |
TOP 15
- Вши и борьба с ними
- Пижма обыкновенная
- Каштан конский обыкновенный
- Роль элементов в жизни растений
- Пшеница
- Иван-чай узколистный
- Календула лекарственная
- Обеззараживание химическими средствами
- Клевер луговой
- Дезинфекция текущая
- Душица обыкновенная
- Бессмертник песчаный
- Как устроены растения
- Хвощ полевой
- Морфологические признаки почвы