


БНБ
"ЭБНБ" (14252)
- Photogallery
- Естественные науки - Математика - Технология
- Авиация и машиностроение
- Высокие технологии
- Вычислительная техника
- Нанотехнология
- Роботехника
- Энергетика
- Электроника
Гель-электрофорез фрагментов днк
Определение "Гель-электрофорез фрагментов днк" в ЭБНБ
 |
| Возникновение и исчезновение вторичной структуры ДНК |
Успехи в разделении крупных молекул двуцепочечной ДНК с помощью различных вариантов пульс-электрофореза в переменном поле заставили исследователей попытаться применить данный подход и к разделению одноцепочечных фрагментов ДНК в денатурирующем полиакриламидном геле. Так, при электрофоретическом разделении секвенируемых молекул ДНК были применены его наиболее простые варианты, основанные на временном прекращении подачи напряжения, а также реверсии электрического поля [Lai et al., 1989; Birren et al., 1990]. Однако существенного увеличения разрешающей способности секвенирующего гель-электрофореза добиться не удалось при одновременном значительном увеличении его длительности. В то же время математический анализ свидетельствовал о теоретическом уменьшении толщины полос ДНК в таком геле, что должно было привести к их большей четкости и большему числу достоверно "читаемых" полос [Slater, Noolandi, 1988]. Другими авторами был предпринят детальный анализ потенциальных возможностей применения переменных электрических полей для целей секвенирования ДНК [Heller, Beck, 1992]. В результате такого исследования они пришли к выводу, что при определенных условиях можно добиться приемлемого соотношения между временем электрофоретического разделения и его разрешающей способностью. Применение более тонких гелей (0,1 мм против довольно обычных 0,2 мм) показало, что подход с использованием пульс-электрофореза все же позволяет осуществлять "чтение" в области 800-900 нуклеотидов [Noolandi et al., 1993]. Компьютерная реконструкция сканированного изображения радиоавтографа позволила этим авторам продлить границу "чтения" за 1000 нуклеотидов и отдельные индивидуальные основания могли быть "прочитаны" таким способом за пределами 2000 нуклеотидов.
Классической буферной системой для секвенирующего гель-электрофореза является трис-боратный буфер, имеющий рН 8,3 [Махат, Gilbert, 1977; Sanger et al., 1977; Sanger, Coulson, 1978]. Стандартной однократной концентрацией этого буфера считается 89 мМ трис и 8,9 мМ борная кислота, а также 2 мМ ЭДТА. В отдельных случаях используют или половинные, или, наоборот, слегка увеличенные концентрации буферного раствора. Считается, что для разделения фрагментов ДНК большего размера необходимы увеличенная концентрация ЭДТА (до 4 мМ) и более высокий рН (до 8,8). В литературе имеются также сведения об использовании, например, трис-цитратного буфера [Landick et al., 1984]. Было отмечено, что ввиду присутствия в секвенируемых образцах ДНК, приготовленных ферментативным методом, крайне незначительного (но достаточного для нежелательного эффекта) количества глицерина, содержащегося изначально в самом ферментном препарате происходит деформация полос ДНК в верхней части геля, особенно при длительных электрофорезах [Fuller, 1989]. Автор подчеркивает, что причина этого явления не ясна, однако, вероятно, здесь происходит образование сложных эфиров борной кислоты и глицерина, оказывающих заметное воздействие на картину электрофоретического разделения больших фрагментов ДНК в верхней части геля. В дальнейшем было показано, что замена борной кислоты на таурин (β-аминоэтансульфокислота) позволяет преодолеть это негативное явление (Pisa-Williamson, Fuller, 1992]. Секвенирующий диск-электрофорез с использованием для нижней и верхней электрофоретических камер обычного трис-бората, а в качестве гелевого буфера трис-сульфата позволил несколько сократить время электрофоретического разделения при некотором увеличении его разрешающей способности [Carninci et al., 1990].
При электрофоретическом разделении радиоактивно меченной ДНК небольшие фрагменты, а также остатки непрореагировавшей метки могут выходить из геля в нижний буферный резервуар, загрязняя его. С целью освобождения нижнего буфера от радиоактивного загрязнения и превращения его в твердые радиоактивные отходы был предложен способ сорбции радиоактивных нуклеотидов и мелких фрагментов ДНК на анионно-обменной смоле путем колоночной хроматографии [Kaczorowski et al., 1994]. Эффективность данного процесса весьма высока и приближается к 100%, поэтому уже не требуется обращения с отработанным нижним буферным раствором как с жидким радиоактивным отходом и он после такой дезактивации может быть просто слит в раковину.
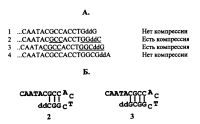
Уже упоминавшаяся компрессия фрагментов ДНК при их разделении секвенирующим гель-электрофорезом представляет одну из самых серьезных проблем, которая приводит, подчас, к неверному прочтению правильной последовательности отдельных нуклеотидов. Известно, что такая аномальная подвижность определенных фрагментов ДНК вызвана формированием участков со вторичной структурой на 3'-конце новосинтезированного фрагмента ДНК. Если внимательно рассмотреть процесс образования компрессии, то можно видеть, что обычно в ее формировании принимают участие 3-4 нуклеотида (по одной цепи), представляющие собой, как правило, G- и С-основания (рис. 4.4). Причем до какого-то участка ДНК никаких "шпилечных" структур не возникает и фрагмент ДНК имеет нормальную подвижность. Но следующий по размеру фрагмент ДНК, показывающий компрессию, отличается от предыдущего только на один терминальный нуклеотид (дидезо-ксинуклеотид). Проксимальным дезоксинуклеотидом (N - 1) для данного фрагмента является тот же терминальный дидезоксинуклеотид предыдущего фрагмента. Таким образом, добавление только одного очередного нуклеотида приводит к формированию участка вторичной структуры. Дальнейшее увеличение рассматриваемого здесь фрагмента ДНК еще на 1-2 нуклеотида сохраняет за ним сформировавшийся участок вторичной структуры и, как следствие, имеет место компрессия полос ДНК. Однако при присоединении последующих нуклеотидов подобные "шпилечные" структуры теряют свою прочность, исчезает эффект компрессии и фрагмент ДНК приобретает свою обычную подвижность.
Интересное исследование влияния соседних нуклеотидов на подвижность фрагментов ДНК было проведено в связи с проблемой компрессии ДНК [Bowling et al., 1991]. Авторы провели детальное исследование подвижности различных фрагментов ДНК, различающихся своими терминальными, проксимальными (N - 1) и антепроксимальным (N - 2) нуклеотидами. Ими было обнаружено, что если фрагмент ДНК несет на своем 3'-конце ddC, то он будет обладать наибольшей подвижностью и будет максимально приближен к предшествующему ему более короткому фрагменту ДНК, отличающемуся на один нуклеотид. И если у предшествующего фрагмента ДНК этот нуклеотид будет ddT, характеризующийся минимальной подвижностью, то высока вероятность плохого разделения таких фрагментов ДНК. По крайней мере, по данным этих авторов, в диапазоне до 400 нуклеотидов фрагменты ДНК с различными терминальными ддНМФ характеризуются следующей подвижностью:
быстрее ← ddC ← ddA ← ddG ← ddT ← медленнее,
причем пурины обладают весьма близкими величинами подвижности.
В случае, когда dC и dT являются проксимальными нуклеотидами, их влияние на подвижность также весьма заметно и кардинально отличается от приведенного выше для терминальных нуклеотидов. Так, при нахождении в проксимальном положении dT такие фрагменты ДНК будут обладать наибольшей подвижностью, a dC - наоборот:
быстрее ← dT-ddN ← dR-ddN ← dC-ddN ← медленнее.
Для "медленных" dC-ddT олигомеров присутствие антепрокси-мального пурина сделает подвижность таких фрагментов ДНК быстрее по сравнению с пиримидином в этом положении:
быстрее ← dR-dC-ddT ← dR-dC-ddT медленнее.
В результате проведенного исследования авторы цитируемой работы пришли к заключению, что выявленные ими некоторые отличия в подвижности фрагментов ДНК зависят не только от их общей молекулярной массы и заряда, но и от весьма заметного взаимодействия различных нуклеотидов, находящихся на 3'-конце разделяемых гель-электрофорезом фрагментов ДНК.
В первоначальных экспериментах после завершения электрофореза гель во избежание диффузии полос ДНК в замороженном виде экспонировали на рентгеновскую пленку. Однако в этом случае присутствующие в геле вода и мочевина способствовали "гашению" радиоактивных сигналов и полосы ДНК на радиоавтографе получались нечеткими. Введенный впоследствии этап фиксации олигонуклеотидов в геле с помощью 10%-ной уксусной кислоты, кроме перевода нуклеиновых кислот в нерастворимую форму, удалял мочевину. Уже упоминавшийся выше маркерный краситель - бромфеноловый синий - является рН-ин-дикатором и в тех случаях, когда он не успевает выйти и остается в геле, по изменению его окраски с фиолетово-синей на желто-коричневую можно судить об изменении кислотности среды в самом геле. Последующее кратковременное выдерживание фиксированного геля в 10%-ном метаноле или этаноле удаляло следы уксусной кислоты. После удаления избыточной влаги такой гель, завернув в кухонную пленку Saran Wrap, уже можно было экспонировать на рентгеновскую пленку. Однако присутствующая в геле вода затрудняла проведение этапа радиоавтографии. Дальнейшим шагом на пути улучшения качества получаемых сигналов на рентгеновской пленке стало высушивание фиксированных гелей в специальных аппаратах для сушки. Гель после завершения электрофореза и его фиксации переносился вместе с бумагой ЗМ на лист пористого полиэтилена в сушителе гелей. Несмотря на то, что многие приборы обеспечивали высушивание при повышенной температуре, продолжительность этого процесса сильно зависит от вакуумного разрежения, создаваемого различными типами насосов, и в случае использования простого водоструйного насоса весьма значительна. Отрицательным моментом является также то, что немного недосушенный полиакриламидный гель имеет свойство при разгерметизации мгновенно трескаться и съеживаться и спасти такой гель уже не представляется возможным. Разработанный подход все же применялся весьма активно и повлек за собой производство специальных сушителей гелей с рабочей площадью, пригодной для сушки больших секвенирующих гелей. Такие высушенные гели могли экспонироваться на рентгеновскую пленку без опасения их прилипания к желатиновому слою при комнатной температуре без дополнительного слоя пленки Saran Wrap, что приводило к увеличению четкости полос. Немаловажной чертой высушенных гелей, также повышающей разрешение, является, кроме отсутствия самой воды, их меньшая толщина по сравнению с влажными.
Обработка одного из стекол γ-метакрилоксипропилтриметоксисиланом привела к образованию на его поверхности реакционно способных групп. В результате полимеризации полиакриламидного геля он оказывается ковалентно "сшитым" с таким стеклом и при высушивании продолжает оставаться прочно связанным, не меняя свои размеры за исключением толщины [Ansorge, De Maeyer, 1980; Garoff, Ansorge, 1981]. После окончания электрофореза стекла разъединялись и гель, приполимеризованный к одному из стекол, фиксировали в уксусной кислоте и затем после непродолжительного выдерживания в 10%-ном этаноле или метаноле высушивали. Следует отметить, что второе стекло необходимо обрабатывать диметилдихлорсиланом во избежание прилипания геля к нему. При пассивном высушивании при комнатной температуре гель может сохнуть в течение ночи. Для ускорения этого процесса можно применить или фен с теплым воздухом, или поместить стекло с гелем в термостат с температурой не выше 80°С. При использовании клиновидных гелей на этапе фиксации в уксусную кислоту иногда необходимо добавить 2-3% глицерина во избежание растрескивания геля. Метод высушивания полимеризованных на стекле гелей до-вольно прост и удобен, но весьма серьезным недостатком является исключение из обращения стекол на время радиоавтографии. Вторым недостатком является относительно сложное удаление геля со стекла после завершения этапа радиоавтографии. С этой целью стекло с гелем выдерживают в воде и затем влажный гель удаляют каким-либо пластиковым скребком. Другим способом является выдерживание стекла с гелем в растворе 1М гидроокиси натрия до тех пор, пока гель сам не отстанет от стекла.
Предложенный впоследствии метод высушивания геля на стекле, не обработанном γ-метакрилоксипропилтриметоксисиланом, позволяет удалять гель без применения щелочи [Lang, Burger, 1990]. Однако стекло перед полимеризацией геля все же требует травления щелочью и полного исключения контакта с диметилдихлорсиланом. Еще один подход к фиксации и последующему высушиванию геля заключается в использовании специальных Gel-Fix пленок.
| "ЭБНБ" >> "Г" >> "ГЕ" >> "ГЕЛ" |
Статья про "Гель-электрофорез фрагментов днк" в Энциклопедии БНБ была прочитана 8418 раз
| Бургер двойного помола |
| Луковый соус |
TOP 15
- Вши и борьба с ними
- Пижма обыкновенная
- Каштан конский обыкновенный
- Роль элементов в жизни растений
- Пшеница
- Иван-чай узколистный
- Календула лекарственная
- Обеззараживание химическими средствами
- Клевер луговой
- Дезинфекция текущая
- Душица обыкновенная
- Бессмертник песчаный
- Как устроены растения
- Морфологические признаки почвы
- Хвощ полевой