


БНБ
"ЭБНБ" (14252)
- Photogallery
- Естественные науки - Математика - Технология
- Авиация и машиностроение
- Высокие технологии
- Вычислительная техника
- Нанотехнология
- Роботехника
- Энергетика
- Электроника
Секвенирующий днк гель
Определение "Секвенирующий днк гель" в ЭБНБ
 |
| Искривление полос ДНК |
 |
| Гребенки для секвенирующего полиакриламидного геля |
 |
| Радиоавтограф секвенирующего геля |
Желание экспериментаторов "читать" с одного геля как можно больше полос ДНК привело к использованию сверхдлинных гелей, что увеличило разрешающую способность метода электрофоретического разделения. Так, в числе первых приборов, доступных из коммерческих источников, был прибор модели S1 фирмы "Bethesda Research Laboratories" (США) с максимальной длиной геля до 85 см. В настоящее время ряд фирм производят электрофоретические камеры, приспособленные для работы со стеклами длиной 80 см. В литературе имеются сведения о применении метровых гелей [Ansorge, Barker, 1984]. "Платой" за "чтение" большего числа нуклеотидов при этом является определенная трудность обращения с такими длинными стеклами и гелями.
Другой крайностью является использование миниатюрного ультратонкого (50 мкм) геля, заливаемого между предметными стеклами для микроскопа, размерами 25 х 75 мм [Stein et al., 1998]. Электрофоретической камерой для такого геля служил обычный прибор для горизонтального агарозного электрофореза, время разделения в котором составляло около 6-7 мин. Несмотря на столь малые размеры геля авторам цитируемой работы при использовании в качестве метки радионуклида 35S удалось "прочитать" с рентгеновской пленки после 16-часовой экспозиции более 150 нуклеотидов.
Стекла довольно маленького размера (обычно 14 см, но с возможным варьированием от 6 см до 20 см) для секвенирующего гель-электрофореза использовались со специальным прибором, рассчитанным на прямое электрофоретическое блокирование [Beck, Pohl, 1984]. Принцип метода заключается в постоянном движении специальной нейлоновой мембраны и ее тесном контакте с нижним срезом геля. Таким образом, фрагмент ДНК, выходя из геля, переносится на данную мембрану и сорбируется в определенном месте. Поскольку используемая длина геля оказывается достаточной для разделения одного фрагмента ДНК, отличающегося на один нуклеотид, от другого, то отпадает надобность в стеклах большого размера, требующих значительно большего времени до выхода образца из геля. После экспозиции данной мембраны с сорбированными на ней фрагментами ДНК на рентгеновскую пленку удается прочитать 500-600 и даже около 1000 нуклеотидов.
Движение молекул ДНК в электрическом поле в полиакриламид-ном геле имеет логарифмическую зависимость и в связи с этим в нижней части расстояние между полосами ДНК, отличающимися на один нуклеотид, значительно больше, чем в верхней части. Таким образом, другим подходом к увеличению числа "читаемых" нуклеотидов с одного геля могло стать не увеличение его длины, а уложение по всей длине геля большего количества полос ДНК за счет постепенного замедления движения молекул ДНК в его нижней части. Это одновременно приводило бы к некоторому увеличению времени электрофореза и фрагменты ДНК крупного размера могли преодолевать чуть большее расстояние, которое уже позволяло осуществить их достоверное "прочтение". Так, применение гелей с градиентом буфера, образуемым при заливке и приводящим к локальному изменению электрического сопротивления геля, позволило с геля стандартной длины "прочитать" нуклеотидов на треть больше, чем обычно [Biggin et al., 1983]. Создаваемый градиент буфера приводил к изменению (увеличению) ионной силы раствора в нижней части геля и поэтому происходило заметное снижение локального градиента напряжения и, как следствие, имело место торможение более мелких фрагментов ДНК. Однако приготовление такого геля с градиентом буфера весьма непросто. Для контроля должной линейности формирования градиента необходимо использовать маркерный краситель бромфеноловый синий, добавляемый в раствор с высокой концентрацией буфера.
Аналогичный эффект замедления движения фрагментов ДНК меньшего размера достигался также при применении гелей с электролитическим градиентом [Sheen, Seed, 1988]. В этом случае готовился обычный секвенирующий гель с однократным буфером, но нижний резервуар содержал, кроме буфера, 1М ацетат натрия, тогда как в верхней камере концентрация буфера была половинной. Известны работы, где подобный электролитический градиент формировался за счет 0,1 или 0,2М фосфата натрия [Lang, Burger, 1990].
Был реализован еще один интересный подход по замедлению движения мелких фрагментов ДНК в секвенирующем геле [Ansorge, Labeit, 1984; Olsson et al., 1984]. В однородном геле градиент напряжения является постоянным, поскольку электрическое сопротивление геля прямо пропорционально длине геля и обратно пропорционально его сечению. Применение клиновидной формы геля с толщиной 0,2 мм в верхней части и до 1 мм в нижней позволило изменить градиент напряжения и затормозить движение мелких фрагментов ДНК, что привело к уменьшению расстояния между полосами ДНК и, таким образом, увеличило число "читаемых" полос с одного геля. Однако для приготовления таких гелей в приборах некоторых типов требовались специальные спейсеры клиновидной формы. В то же время заливка гелей клиновидной формы техникой скольжения позволяла обойтись лишь дополнительным коротким фрагментом спейсера необходимой толщины, накладываемым на основной спейсер в его нижней части. Применение спейсеров с экспоненциально меняющейся толщиной позволило эффективно разделять более 500 нуклеотидов [States et al., 1991]. Некоторым недостатком таких гелей с переменным сечением является их более высокая толщина в нижней части, затрудняющая высушивание.
Увеличение числа полос, умещающихся на геле, теоретически могло бы быть осуществлено также путем создания плавно увеличивающегося градиента концентрации полиакриламида. Однако из-за большого размера гелевой пластины и малой толщины заливка такого геля практически невозможна. Частичное решение проблемы состояло в приготовлении геля со ступенчатым изменением концентрации полиакриламида для названного авторами "4-6-8 метода" секвенирования, позволяющего успешно разделять свыше 500 нуклеотидов [Isfort, Ihle, 1988]. Используемые 6%-ные полиакриламидные гели и для протяженных фрагментов ДНК даже 3%- или 4%-ные против 8%- или 20%-ных, предлагавшихся ранее, позволили резко увеличить число разделяемых и "читаемых" полос ДНК [Ansorge, Barker, 1984].
Здесь надо отметить, что качество электрофоретического разделения в значительной степени зависит от правильности приготовления и заливки самого геля. Не последнюю роль играет и чистота используемых реактивов. Мономеры - акриламид и метиленбисакриламид должны быть несколько раз перекристаллизованы и при появлении желтоватой окраски приготовленного концентрированного раствора, свидетельствующей об образовании, в том числе, акриловой кислоты, заменены новыми. Оба этих мономера являются нейротоксичными и обращение с ними, в особенности взвешивание, требует соблюдения строгих правил. В связи с этим многими фирмами поставляются концентрированные растворы этих соединений. Некоторые фирмы пошли еще дальше и для своих электрофоретических камер для секвенирующего электрофореза поставляют уже готовые гели.
Полимеризация полиакриламидного геля есть каталитический процесс, протекающий с помощью тетраметилендиамина и персульфата аммония. Хорошо известно, что последний при длительном хранении своих водных растворов частично теряет реакционные свойства и в связи с этим рекомендуется использование свежеприготовленных растворов. Для исключения многократного взвешивания персульфат аммония поставляется некоторыми фирмами в виде желатиновых капсул с заранее отвешенными количествами. Удобство использования таких фасовок может оборачиваться при секвенировании ДНК нежелательным эффектом "размазывания" полос ДНК в верхней части геля [Kamps-Holtzapple, Stanker, 1995]. Этими авторами был проведен модельный эксперимент, в котором выяснилось, что именно желатин оказывает такой отрицательный эффект, и они советуют в связи с этим просто вскрывать капсулы и высыпать их содержимое, исключив, таким образом, растворение желатины. Довольно сильным ингибитором полимеризации является растворенный в воде кислород, и для его максимального удаления рекомендуется дегазация уже готового раствора мономеров перед добавлением инициатора и катализатора этого процесса.
Сам гелевый матрикс тоже не остался без изменения. Был предложен раствор геля HydroLink, имеющий целый ряд преимуществ перед стандартным полиакриламидным гелем, и мономеры которого к тому же менее токсичны по сравнению с акриламидом [Gelfi et al., 1990]. Этот гель характеризуется более высокой механической прочностью и химической стабильностью, позволяющей применять буферы с высоким рН. По существу, щелочные условия проведения секвенирующего гель-электрофореза, исключающие формирование у одноцепочечных фрагментов ДНК вторичной структуры без использования мочевины, позволили сократить время обращения с таким гелем перед этапом радиоавтографии за счет исключения необходимого ранее этапа ее удаления. Отсутствие мочевины в геле имеет также еще одно небольшое преимущество, заключающееся в более удобном нанесении препаратов ДНК в ячейки геля, чему обычно препятствует диффундирующая в буфер мочевина. Результатом применения такого геля стало большее количество (свыше 600) и более высокое качество "читаемых" полос ДНК с радиоавтографа геля.
Учитывая большой размер секвенирующего геля и его крайне малую толщину, качественная заливка представляет достаточно серьезную проблему. Обеспечение герметичности пространства для геля, формируемого двумя стеклами и спейсерами между ними, является важным условием, которое достаточно подробно рассмотрено в ряде статей [Damay, Engel, 1992; Bollet et al., 1993; Law, Ferrell, 1994; Hengen, 1996]. Главную проблему здесь представляет нижний срез стекол, который или помещается в специальное устройство, поставляемое с некоторыми моделями секвенеров, или обклеивается липкой лентой. К другим вариантам можно отнести применение нижнего спейсера аналогичной толщины с боковыми, который потом необходимо удалить, или использование вместо такого спейсера подходящей фильтровальной бумаги, которую можно оставить. Однако, например, при заливке геля для автоматического секвенера или для прямого блоттинга последний способ не годится. Предложенный метод заливки секвенирующих гелей техникой скольжения [Ansorge, De Mayer, 1980; Garoff, Ansorge, 1981] не требовал какой-либо герметизации, поскольку раствор полимеризующегося полиакриламида удерживался между стеклами, находящимися в горизонтальном положении за счет сил поверхностного натяжения. Похожий способ описан в работе других авторов [Lang, Burger, 1990]. В этом случае верхнее стекло удерживалось над нижним, расположенным горизонтально под небольшим углом, и в образующееся пространство выливался сразу весь рассчитанный объем полиакриламидного геля, после чего верхнее стекло опускалось на нижнее с некоторым накатом вперед. В то же время следует отметить, что оба последних способа не позволяют, например, залить гель с градиентом буфера или сформировать предгель, не содержащий буфера и мочевины. В литературе встречаются упоминания, что наличие такого предгеля позволяет повысить разрешающую способность этого метода за счет некоего концентрирования фрагментов ДНК перед их вхождением в настоящий гель [Ямщиков, 1990]. Вторая проблема, сопровождающая заливку и присущая всем этим способам, состоит в недопущении образовании пузырьков воздуха, которые могут искажать электрическое поле и ухудшать картину электрофоретического разделения, вплоть до ее полной непригодности. Избежать этого можно, главным образом, за счет качественно вымытых стекол, да и сам раствор мономеров не должен содержать никаких механических загрязнений.
Определенную проблему представляло "чтение" нуклеотидных последовательностей, имеющих сильную вторичную структуру. Возникающая компрессия иногда затрудняла выявление истинного положения отдельных нуклеотидов. Уже упоминавшееся выше в связи с эффектом "улыбки" термостатирование геля при повышенной температуре практически решало и эту проблему [Ansorge, De Maeyer, 1980; Garoff, Ansorge, 1981]. В отдельных, особо трудных, случаях при секвенирова-нии ДНК с очень высоким GC-составом использовался гель с содержанием 40%-ного формамида как дополнительного денатурирующего агента, кроме стандартной мочевины, что не позволяло образовываться "шпилечным" структурам. Однако при этом часто имело место некоторое разбухание геля и было предложено применять только один 50%-ный формамид без мочевины в качестве денатурирующего агента [Khambaty, Ely, 1990]. Был разработан горизонтальный диск-электрофорез с концентрирующим предгелем 0,5 мм толщины, что позволяло осуществить легкое нанесение образцов, и ультратонким 50-микронным основным разделяющим гелем [Carninci et al., 1995]. Такой ультратонкий гель позволял прикладывать к нему высокое напряжение, что приводило к исключению компрессии полос ДНК, принадлежащих фрагментам с высоким GC-составом. Еще более тонкий (25 мкм) горизонтальный гель был предложен для эффективного разделения продуктов секвенирующих реакций [Brumley, Smith, 1991]. Авторы продемонстрировали высокое разрешение, достигаемое в их приборе и очень малое время разделения, составляющее всего 15 мин. Причиной этого было очень высокое напряжение, достигающее 250 В на см длины геля, причем размеры гелевой пластины составляли 8,2 х 25 см. Главным недостатком этой системы была ее довольно сложная конструкция.
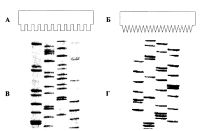
Разработанный в начале 1980-х годов новый тип гребенки - "зубы акулы", названный так за то, что его зубья буквально вонзались в ровную верхнюю границу геля и образовывали, таким образом, перегородки, позволил наносить образец ДНК в соседние дорожки практически без промежутков, что повысило достоверность "чтения" особенно в верхней части геля, и позволило увеличить число "читаемых" полос ДНК за счет "касания" их краев с полосами в соседних треках (рис.). Следует отметить, что у гребенки "зубы акулы" обе стороны являются рабочими, поскольку на стадии полимеризации геля его ровная верхняя граница образуется как раз с помощью гладкой стороны гребенки. Рекомендуемое иногда 8-дорожечное нанесение препарата ДНК, например в последовательности GATCGTAC (хотя оно и менее экономно), также способствует продлению "чтения" в верхней части геля, поскольку в этом случае каждый нуклеотид вплотную соседствует со всеми остальными и, таким образом, значительно легче определить его истинное местоположение относительно других, не прибегая к экстраполяции. Уменьшение расстояния между зубьями и за счет этого уменьшение ширины ячейки для нанесения препарата (причем без заметного ухудшения "чтения") позволили разместить на одном и том же геле большее число анализируемых образцов и, таким образом, повысить производительность каждого конкретного прибора. Стандартные гребенки также стали значительно мельче и обычно формируют ячейки с шириной около 5 мм против использовавшихся ранее 8 или даже 10 мм. Другой способ экономии гелевого пространства был предложен Нельсоном и соавт. [Nelson et al., 1992]. К нанесению образцов ДНК на гель они подошли с математической точки зрения и записали их порядок в бинарных кодах. Так, для секвенирования ДНК ферментативным методом обычный четырехдорожечный порядок нанесения образцов ДНК может быть представлен следующим образом:
G = (1,0,0,0); А = (0,1,0,0); Т = (0,0,1,0); С = (0,0,0,1),
где 1 означает присутствие, а ноль - отсутствие. (При секвенировании ДНК химической деградацией подобная запись выглядит несколько сложнее.) Однако однозначное "прочтение" всех четырех нуклеотидов возможно осуществить после разделения их в виде определенных комбинаций всего в трех соседних дорожках. В цитируемой работе были осуществлены электрофоретические разделения продуктов терминирующих реакций в трех дорожках по двум схемам. Во втором, более приемлемом, варианте порядок нанесения был следующий - GA, GCT и СА, что соответствовало G = (1,1,0); А = (1,0,1); Т = (0,1,0) и С = (0,1,1) после их перевода в бинарный код. Наличие полос одновременно во всех дорожках имело шифр (1,1,1) и свидетельствовало о неспецифической терминации. Следует отметить значительную трудность "чтения" таких радиоавтографов, и экономия четвертой части всего геля может привести к серьезным ошибкам на этапе ее "прочтения". Однако подобное нанесение может иметь некоторый смысл при автоматическом сканировании радиоавтографа геля, где специальная компьютерная программа могла бы определять правильную последовательность нуклеотидов. Что касается автоматического флуоресцентного секвенирования ДНК, то там подобная проблема экономии дорожек, решается по-другому.
Еще один своеобразный способ нанесения препаратов ДНК на секвенирующей гель описан в работе других авторов [Burt et al., 1994]. Так, в предложенном ими варианте при одновременном секвенировании множественных гомологичных фрагментов ДНК схема нанесения образцов выглядела следующим образом: A1,A2,A3,A4,A5,A6,C1,C2,C3,C4,C5,C6,G1,G2... и т.д. Однако надо отметить, что подобное нанесение не подходит для обычного секвенирования ДНК, а предназначено для выявления полиморфизма нуклеотидных последовательностей секвенируемых фрагментов ДНК. При этом различия между последовательностями получаются более наглядными, что и было продемонстрировано в цитируемой выше статье. Особый эффект достигается при использовании гребешка "зубы акулы", поскольку в случае одинаковых азотистых оснований во всех образцах соответствующие им полосы сливаются в одну широкую. Отличающиеся нуклеотиды разрывают такую линию и сразу становятся заметны.
Отсутствие промежутков между соседними матрицами ДНК, наносимыми в виде четырех реакций, как, например, G А Т С, при массовых анализах затрудняло визуальное выделение конкретного образца секвенируемой ДНК. Хотя проблема разграничения образцов ДНК в секвенирующем геле решается простым пропусканием одной дорожки между матрицами, но при этом теряется значительное число дорожек, что довольно не экономно. Этот способ вполне возможен с обеими типами гребенок, однако гребенка типа "зубы акулы" в отличие от обычной позволяет сформировать промежуток между образцами ДНК, не оставляя между ними пустые дорожки. На протяжении многих лет нами использовался подход для формирования промежутков между образцами ДНК путем их последовательного нанесения через небольшой промежуток времени (обычно около 1 мин), за который фрагменты ДНК предыдущей матрицы под действием электрического тока уже успевали войти в сам гель. Этого оказывалось вполне достаточно, чтобы на заключительном радиоавтографе между соседними образцами ДНК была видна вертикальная полоса, хороша заметная на радиоавтографе, фрагмент которого приведен на рис.
Такое последовательное нанесение образцов ДНК с попеременным подключением/отключением источника питания занимает несколько больше времени, чем обычное, но в то же время позволяет перед самым нанесением очередного образца промывать колодцы с целью удаления диффундирующей из геля мочевины, которая несколько мешает нанесению препаратов ДНК. И, во-вторых, как уже отмечалось выше, на заключительном радиоавтографе отдельные матрицы ДНК хорошо заметны в виде четверок дорожек, принадлежащих одному образцу. Более скоростной вариант подобного нанесения, приводящего к формированию промежутков между образцами ДНК, был предложен Нельсоном и Кравецом [Nelson, Krawetz, 1994]. Главное отличие предложенного ими подхода заключалось в нанесении в первый заход нечетных матриц (1, 3,5 и так далее) в соответствующие дорожки (1,2,3,4; 9,10,11,12; 17,18,19,20 и так далее), после чего на 5 мин подавалось рабочее напряжение. А во втором заходе наносились четные матрицы (2, 4,6 и так далее) в оставшиеся пустыми соответствующие дорожки геля. В результате на заключительном радиоавтографе были видны те же вертикальные светлые полоски, разделяющие соседние образцы ДНК.
Стандартным буфером для нанесения образцов ДНК на секвенирующий гель служит добавляемый в терминирующие реакции в виде стоп-раствора формамид с маркерными красителями - ксиленоловым голубым и бромфеноловым синим, имеющими различную подвижность. Данные красители в полиакриламидных гелях разной концентрации движутся с фрагментами ДНК различающихся размеров, что позволяет контролировать процесс разделения продуктов реакции. (Соответствие электрофоретической подвижности данных красителей с определенными фрагментами ДНК в полиакриламидных гелях с мочевиной приведено в Приложении.) В ранних работах рекомендовалось даже после завершения электрофоретического разделения отмечать места локализации этих красителей в геле с помощью радиоактивных чернил с тем, чтобы после радиоавтографии на рентгеновской пленке можно было оценить размер фрагмента ДНК, движущегося рядом с ними. Подобная цель преследовалась и при нанесении на гель радиоактивно меченной с помощью полинуклеотидкиназы и γ-АТФ Oligo (dT)4-22-лестницы, поставляемой в то время фирмой "Bethesda Research Laboratories". В настоящее время необходимость точного определения положения какого-то конкретного нуклеотида от 5' -конца фрагмента ДНК требуется только в определенных случаях, связанных больше не с самим секвенированием, а с соответствующим анализом фрагмента ДНК, например с помощью футпринтинга. Для этой цели экспериментаторы в соседних дорожках обычно "секвенируют" фрагмент ДНК с уже известной последовательностью. Другой альтернативой является использование специальной маркерной лестницы SequaMark, поставляемой фирмой "Research Genetics, Inc." (США), в виде матрицы ДНК с клонированным фрагментом ДНК, в котором остатки аденина встречаются через каждые 10 нуклеотидов. Таким образом, при ферментативном построении новой цепи ДНК в условиях терминации с ддТТФ с использованием соответствующей метки образуется характерная лестница полос, имеющая размер от 10 до 500 нуклеотидов (считая от праймера) со ступеньками, равными 10 нуклеотидам. В качестве реперных зон служат множественные полосы, предшествующие сотням нуклеотидов. Так, в районе 100 нуклеотидов содержится пять полос, соответствующих 96, 97, 98, 99 и самому 100 нуклеотидам. Аналогичная ситуация только с различающимся числом полос характерна для 200, 300, 400 и 500 нуклеотидов.
Иногда при повторном нанесении препаратов ДНК через довольно большой промежуток времени бывает нужно как-то заранее отметить те дорожки секвенирующего геля, в которые уже были нанесены образцы, поскольку маркерные красители и ксиленоловый голубой и тем более бромфеноловый синий успеют отойти от старта на значительное расстояние и определение нужных колодцев "на глаз" чревато ошибкой. В этом случае в буфер для нанесения добавляется декстран голубой, представляющий собой краситель цибакроновый голубой, ковалентно сшитый с декстраном, имеющим молекулярную массу свыше 2 МДа. Таким образом, уже занятые колодцы оказываются отмеченными голубой полоской остающегося на старте декстрана голубого.
Нельзя не упомянуть о недавно предложенной уникальной гребенке, позволяющей осуществить одновременное быстрое, занимающее всего несколько минут, нанесение 200 образцов на полиакриламидный гель шириной 30 см [Erfle et al., 1997]. Эффективность данной гребенки была продемонстрирована при автоматическом секвенировании ДНК в двух различных приборах, хотя авторы утверждают о возможности ее применения как для вертикальных, так и горизонтальных гелей ультратонкой и стандартной толщины. Особенностью этой гребенки является то, что она изготовлена из пористого материала и поэтому образцы ДНК предварительно наносятся на каждый зубец гребенки, впитываются в него и уже затем гребенка с препаратами ДНК, находящимися в зубьях, втыкается в гель. Под действием электрического тока препараты ДНК выходят из гребенки и входят в полиакриламидный гель.
В последнем случае можно отметить совмещение процессов формирования колодцев и нанесения в них образцов ДНК, осуществляемое одномоментно. В то же время провести обычное нанесение в колодцы препаратов ДНК, учитывая весьма небольшую толщину секвенирующих гелей (0,4; 0,2 или даже 0,05 мм) бывает весьма непросто. Так, фирма "Drummond" (США) одной из первых начала выпуск специальных автоматических пипеток для секвенирования с точным дозированием малых объемов и в комплекте с тонкими поликарбонатными наконечниками. Однако простое решение проблемы заключается в самостоятельном изготовлении тонких полипропиленовых наконечников путем оттягивания над пламенем спиртовки обычных желтых наконечников, что при некотором навыке получается без особых сложностей.
Возвращаясь к порядку нанесения образца ДНК на секвенирующий гель, стоит обратить внимание на последовательность расположения различных типов реакций. Так, при секвенировании ДНК методом химической деградации, его классическим вариантом, в первой дорожке обычно разделяются продукты G-реакции, во второй - G + А, в третьей - С + Т и в четвертой - С. Данная последовательность является палиндромом (GRYC), поэтому в случае необходимости "чтения" противоположной цепи ДНК можно просто повернуть радиоавтограф вокруг своей вертикальной оси на 180° и таким образом "читать" комплементарную цепь. Конечно, последовательность комплементарной цепи можно потом легко получить с помощью компьютера, однако на стадии "чтения" различных субклонов, в случае если их последовательности принадлежат разным цепям, это имеет некоторый смысл. Однако существуют некие правила "чтения" тех или иных нуклеотидов в связи с их окружением и поэтому такое "комплементарное" "чтение" "не тех" нуклеотидов может привести к увеличению числа ошибок.
При разделении продуктов секвенирующих реакций, проведенных по методу Сэнгера, существует несколько большая свобода выбора порядка их нанесения на секвенирующий гель. В разных статьях приводятся различные варианты, как, например, - ACGT, AGCT, TCGA, TGCA, GATC или GTAC. Другие варианты также возможны, но непалиндромные последовательности скорее всего нежелательны. Первые четыре варианта предпочтительны, когда секвенируется ДНК с довольно высоким составом GC-nap. В этих случаях высока вероятность компрессии и соседнее расположение G и С дорожек в какой-то степени сможет нивелировать его эффект. Последовательность нанесения в виде GATC также имеет свое объяснение. Поскольку данная последовательность нуклеотидов GATC соответствует сайту узнавания рестрикционной эндонуклеазы Sua3AI, весьма широко используемой для получения субклонов, то лестница полос GATC на соседних дорожках позволяет находить потенциальные границы субклонов. Аналогичное применение находит последовательность нанесения GTAC (сайт узнавания ре-стрикционной эндонуклеазы RsaI) при секвенировании однонаправленных делеционных субклонов, полученных в специализированном векторе pSequoiaT12.
Вероятно, здесь следует отметить (хотя и нелегко объяснить), что палиндромная последовательность нуклеотидов GATC из-за часто применяемых некоторых тетра- и гексануклеотидных рестрикционных эндонуклеаз (BamHI - семейство ферментов), узнающих данную последовательность, приобрела в молекулярной биологии даже некоторое символическое значение. Видимо, поэтому в Германии имеется фирма, производящая оборудование для электрофореза и секвенирования ДНК, название которой и состоит из этих букв/нуклеотидов - "GATC GmbH". Более того, в одном из своих рекламных буклетов данная фирма взяла на себя смелость написать, что "Life's alphabet - GATC", или, в переводе на русский, "GATC - алфавит жизни". Возможно, они правы, поскольку именно это сочетание букв GATC как никакое другое напоминает большинству молекулярных биологов о ДНК, генах, их клонировании и секвенировании.
| "ЭБНБ" >> "С" >> "СЕ" >> "СЕК" |
Статья про "Секвенирующий днк гель" в Энциклопедии БНБ была прочитана 4657 раз
| Бургер двойного помола |
| Кишки на гриле |
TOP 15
- Вши и борьба с ними
- Пижма обыкновенная
- Каштан конский обыкновенный
- Роль элементов в жизни растений
- Пшеница
- Иван-чай узколистный
- Календула лекарственная
- Обеззараживание химическими средствами
- Клевер луговой
- Дезинфекция текущая
- Душица обыкновенная
- Бессмертник песчаный
- Как устроены растения
- Морфологические признаки почвы
- Хвощ полевой