


БНБ
"ЭБНБ" (14252)
- Photogallery
- Естественные науки - Математика - Технология
- Авиация и машиностроение
- Высокие технологии
- Вычислительная техника
- Нанотехнология
- Роботехника
- Энергетика
- Электроника
Прямое секвенирование пцр-продукта
Определение "Прямое секвенирование пцр-продукта" в ЭБНБ
 |
| Асимметричная ПЦР |
 |
| Температурная асимметричная ПЦР |
 |
| Получение одноцепочечной матрицы |
 |
| Создание одноцепочечной матрицы |
Другой отрицательный эффект от присутствия в реакционной смеси второй комплементарной цепи состоит в образовании неспецифических "стопов", происходящих из-за "утыкания" ДНК-полимеразы, удлиняющей нормально отожженый праймер, в двуцепочечный участок матрицы, образовавшийся в результате отжига на ней комплементарной цепи ДНК, тогда как остальная часть цепи оказалась неспаренной, что и дало возможность ДНК-полимеразе до поры, до времени, а точнее, до данного места, осуществлять синтез второй цепи ДНК [Kusakawa et al., 1990; Rao, Saunders, 1992; Rao, 1994]. Подобные места могут быть или произвольно распределены по всей длине матрицы ДНК, или располагаться в некоторых участках, где в силу определенной нуклеотидной последовательности восстановление двуцепочечной структуры происходит особенно быстро [Olsen, Eckstein, 1989]. На заключительном радиоавтографе для таких мест будет характерно наличие полос во всех четырех дорожках, не позволяющее осуществить достоверное "прочтение" этих нуклеотидов. В некоторой степени это можно преодолеть довольно быстрым охлаждением раствора денатурированной матрицы до 12° С в присутствии избытка олигонуклеотидного праймера, поскольку более короткий праймер все же успевает в этих условиях отжечься на комплементарном участке. В этой же работе было показано, что видимый в агарозном геле как единая полоса ПЦР-продукт в действительности, при его анализе в секвенирующем геле, представляет собой достаточно гетерогенную смесь основного продукта и более коротких полупродуктов, причем последние при секвенировании также приведут к упомянутым выше "стопам". В работе других авторов [Casanova et al., 1990] была исследована эффективность секвенирования двуцепочечного ПЦР-продукта в зависимости от времени отжига олигонуклеотидного праймера. Наилучшие результаты были получены в случаях максимально быстрого охлаждения, занимающего всего 15 с, что достигалось путем помещения пробирки с матрицей, денатурированной нагревом в присутствии праймера, на -70° С.
Еще одна проблема секвенирования продуктов амплификации заключается в неиспользованном в ходе ПЦР большом количестве дНТФ и олигонуклеотидных праймеров, что делает невозможным прямое секвенирование ПЦР-продуктов без соответствующих процедур удаления этих ингредиентов. Обычно в ПЦР используется не более 10% праймеров и их избыток вместе со взятой аликвотой для секвенирования, таким образом, перенесется в следующую реакцию. Поскольку в качестве секвенирующего праймера может быть добавлен или третий праймер, или даже один из амплификационных, предварительно меченный по своему 5'-концу, то олигонуклеотидные праймеры из первой реакции не могут сделать секвенирование ДНК невозможным. Но они будут конкурировать с секвенирующим праймером за места отжига, занимать молекулы ДНК-полимеразы и расходовать дНТФ и ддНТФ и за счет этого снижать выход целевого продукта. Все это вместе приведет к ухудшению результатов секвенирования амплификатов.
Избыток дНТФ, перенесенный вместе с ПЦР-продуктом в реакцию секвенирования, представляет даже большую проблему. Обычная концентрация дНТФ в ПЦР составляет 0,2 мМ для каждого нуклеотида. После 25 циклов, как правило, используется около 3% от их исходного количества, что зависит от длины амплифицируемого фрагмента и эффективности всего процесса. Однако такая высокая концентрация дНТФ требуется отчасти из-за небольшой продолжительности этапа удлинения комплементарной цепи ДНК и необходимости его полного завершения, поскольку в противном случае экспоненциальное течение реакции будет невозможно. Таким образом, присутствие очень большого количества дНТФ не позволяет на этапе секвенирования ДНК выполнить необходимые соотношения дНТФ/ддНТФ, поскольку последних придется добавить так много, что проект по секвенированию ДНК с помощью ПЦР и Taq ДНК-полимеразы станет чрезмерно дорогим.
Эффективное секвенирование ПЦР-продуктов требует удаления дНТФ и праймеров из первой реакции, остающихся в избытке после ее завершения, что может быть осуществлено с помощью различных методов, основывающихся, главным образом, на заметной разнице в размерах дНТФ (менее 600 Да), олигонуклеотидных праймеров (в среднем - около 8000 Да и обычно не превышающих 12 000 Да) и самих продуктов ПЦР в виде двуцепочечных фрагментов ДНК, характеризующихся значительно большей молекулярной массой [Gyllensten, 1989]. Достаточно простым способом является осаждение ДНК, полученной в ходе ПЦР, в условиях неосаждения дНТФ и коротких фрагментов ДНК, каковыми являются праймеры. Сообщается об использовании для этой цели полиэтиленгликоля [Kusukawa et al., 1990], количественно осаждающего фрагменты ДНК крупнее 150 пн, тогда как более мелкие он осаждает плохо или совсем не осаждает [Paithankar, Prasad, 1991]. Аналогичное действие оказывает изопропанол. Применяется также ультрафильтрация с пороговыми величинами 30 000 Да [Nichols, Raben, 1994] или 100 000 Да [Krowzczynska, Henderson, 1992], ниже которых ингредиенты предыдущей реакции удаляются. Этот же принцип ультрафильтрации лежит в основе спин-диализа в микроцентрифуге с помощью специальных микроконцентраторов Centricon 30 фирмы "Amicon" (США), продемонстрировавшего эффективное удаление оставшихся в ходе ПЦР дНТФ и олигонуклеотидных праймеров, что позволило провести успешное секвенирование полученного продукта [Gal, Hohn, 1990; Wong et al., 1987].
Следует отметить описанную возможность ферментативного удаления неиспользованного количества праймеров после завершения первой стадии ПЦР с помощью экзонуклеазы VII [Li et al., 1991]. Экзонуклеаза VII проявляет свою активность по отношению к одноцепочечным фрагментам ДНК, начиная одновременный гидролиз как с 5'-, так и с 3'-концов, не оказывая при этом заметного действия на двуцепочечные продукты амплификации. Был предложен и другой подход, требующий, как и при осаждении фрагментов ДНК, только одну пробирку и заключающийся в ферментативном разрушении с помощью экзонуклеазы I и щелочной фосфатазы краба неиспользованных дНТФ и праймеров [Werle et al., 1994]. Метод относительно прост и исключает потерю ДНК во время многочисленных процедур, применяемых при очистке ПЦР-продуктов более сложными методами, описанными ниже.
Как уже отмечалось выше, в ходе ПЦР случается, что образуется смесь гетерогенных молекул ДНК, и тогда простое осаждение или ферментативная обработка, хотя и исключат из дальнейшего этапа секвенирования мешающие дНТФ и праймеры из первой реакции, однако не решат проблему наличия посторонних ДНК. В этой связи было предложено проводить очистку амплификатов с помощью электрофореза в агарозном или полиакриламидном гелях или хроматографией, что одновременно удаляло непрореагировавшие дНТФ и праймеры, а также позволяло в дальнейшем проводить секвенирование именно того фрагмента ДНК, который и был намечен. После проведения электрофоретического разделения дальнейшие процедуры по очистке нужных фрагментов ДНК из геля могут быть практически любыми, начиная от простого замораживания/оттаивания до электроэлюции [Маниатис и др., 1984; Sambrook et al, 1989; Cao, Brosius, 1993]. Описанные в литературе способы выделения фрагментов ДНК из геля, позволяющие осуществить дальнейшее эффективное секвенирование, состоят в их элюции на ДЭАЭ-бумагу [Nickrent, 1994], в разрушении агарозы под действием агаразы [Gold, 1992] или сорбции биотинилированной ДНК (за счет одного из праймеров, несущего биотин) из расплава геля на магнитных частицах со стрептавидином [Green et al., 1990]. Использование других магнитных частиц, покрытых карбоксилом, способных в присутствии полиэтиленгликоля и NaCl обратимо сорбировать ДНК, уже не требовало наличия биотиновой метки [DeAngelis et al., 1995]. Сообщается также о разделении продуктов амплификации в легкоплавкой ага-розе и использовании в дальнейшем секвенировании с помощью секвеназы данного ПЦР-продукта прямо вместе с расплавленным кусочком легкоплавкой агарозы, не прибегая к элюции, что, впрочем, не позволило на этапе мечения снижать температуру инкубации ниже 37° С, во избежание образования при этом в реакционной смеси геля [Kretz et al., 1989; Kretz et al., 1990].
Был предложен интересный подход к элюции ПЦР-фрагмента ДНК из полиакриламидного геля, заключающийся в предварительном высушивании геля, окрашенного бромистым этидием, и с наложенным на него кусочком фильтровальной бумаги, вырезанному по размеру полосы ДНК [Wu et al., 1996]. Далее, поскольку размер фильтровальной бумаги строго соответствовал размеру исследуемой полоски ДНК, то вырезался кусочек сухого полиакриламидного геля, исходя из контуров бумаги. После прогрева в течение 15 мин в микроцентрифужной пробирке этого кусочка геля вместе с бумагой, последняя удалялась центрифугированием. Есть работы, в которых элюция из полиакриламидного геля продукта ПЦР для его последующего секвенирования осуществлялась простой диффузией в солевой раствор в течение ночи [Huber, McMahon, 1988]. Недавно было сообщено об использовании специального небулай-зера (Gel Nebulizer) (Millipore, США) для выделения ПЦР-продукта из агарозного геля, пригодного для последующего его секвенирования [Leonard et al., 1998]. Это устройство представляет собой своеобразную колонку с соплом, рассчитанную на центрифугирование в микроцентрифуге при 10 000g, и предназначено для элюции ДНК из образующихся в этом процессе мельчайших кусочков агарозного или полиакриламидного гелей. Причем данная процедура требует всего около 10 мин. Также весьма быстрая очистка ПЦР-продуктов, завершаемая всего за 7-20 мин, возможна с помощью хроматографии высокого давления [Katz, Dong, 1990; Kalnoski et al., Warren, Doninger, 1991], что, однако, требует наличия специального дорогостоящего оборудования.
В то же время в литературе встречаются сообщения об успешном секвенировании ПЦР-продуктов без какой-либо их очистки [Meltzer et al., 1990; Srivastava et al., 1992; Douglas et al., 1993; Liu et al., 1993]. Непременным условием этого является, как уже отмечалось выше, наличие единственного целевого продукта и отсутствие гетерогенных амплификатов. Другим условием является использование в ПЦР относительно низких концентраций в реакционной смеси как дНТФ, так и олигонуклеотидных праймеров. Так, в качестве примера можно привести работу, в которой в первую фазу (30 циклов) осуществлялась амплификация фрагмента ДНК с помощью ДНК-полимеразы Thermus flavus в присутствии всего 10 мкМ каждого из дНТФ, а во вторую фазу, после добавления меченого праймера (одного из амплификационных) и соответствующих количеств ддНТФ уже проводились терминирующие реакции [Rao, Saunders, 1992]. В другой работе в качестве фермента использовалась ДНК-пол имераза Deep VentR®(exo-) из архебактерии Pyrococcus sp., способная к эффективному построению цепей ДНК при достаточно низких концентрациях дНТФ, что также не потребовало удаления невключившихся ингредиентов из первой реакции [Манате, 1996].
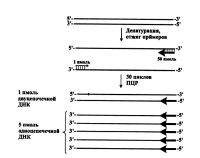
Хорошо известно, что гораздо лучшие результаты дает секвенирование одноцепочечной ДНК, которая не содержит в реакционной смеси комплементарной цепи. Существует много подходов к достижению этой цели как на этапе самой ПЦР, так и после ее завершения. Самым простым вариантом можно считать подход, заключающийся в проведении второй стадии ПЦР уже только с одним праймером с небольшой аликвотой, взятой из первой реакции [Kaltenboeck et al., 1992]. Хотя необходимо отметить, что вместе с ДНК-продуктом в этом случае перенесется и второй праймер, который будет присутствовать хотя и в меньшей концентрации, но все же будет принимать участие в амплификации, приводя к образованию и второй цепи ДНК. Таким образом, можно считать, что амплификация проводится с двумя праймерами, имеющими разную концентрацию, что и было реализовано в виде асимметричной ПЦР, описанной ниже. Так, достаточно простой способ наработки одной из цепей фрагмента ДНК состоит в асимметричной амплификации, которая становится возможной из-за значительной разницы (в 50-100 раз) в количестве присутствующих в реакционной смеси двух праймеров [Gyllensten, Erlich, 1988; Innis et al., 1988; Wilson et al., 1990]. В результате во время ПЦР происходит истощение первого праймера (представленного в низкой концентрации), что приводит к накоплению в последующих циклах одноцепочечных продуктов удлинения второго праймера (рис.). Серьезными недостатками этого подхода являются неоптимальные условия амплификации, заметно снижающие выход целевого продукта, и необходимость в отдельных случаях экспериментальным путем подбирать оптимальное количественное соотношение этих двух праймеров.
Подобный эффект достижим и при использовании двух праймеров, имеющих сильно отличающуюся температуру отжига. Этот процесс, названный авторами [Mazars et al., 1991] "температурной асимметричной ПЦР", заключается в проведении первых 25 циклов при низкой температуре отжига, характерной для одного из праймеров и приемлемой одновременно и для второго, и уже затем следует проведение дальнейших циклов при более высокой температуре, соответствующей температуре отжига второго праймера, что не позволяет, таким образом, отжечься первому (рис.). Результатом этого будет накопление в этих циклах второго этапа только одной цепи ДНК, представляющей собой продукт ферментативного удлинения второго праймера.
Своеобразный способ "удаления" из реакции одной из цепей ДНК, полученной в ходе ПЦР, осуществляется путем ее гибридизации с клонированным ранее в соответствующей ориентации подобным (гомологичным) фрагментом в одноцепочечном векторе М13 [Gal, Hohn, 1990; Gal, 1993, 1996]. Причем клонированный фрагмент не должен содержать места отжига амплификационных и секвенирующего праймеров, чтобы не вызывать конкуренцию. В цитируемой работе показано улучшение качества картины секвенируемых полос ДНК после добавления в реакционную среду возрастающих количеств одноцепочечной ДНК вектора М13, несущего вставку, что объясняется одновременным увеличением доступного для ДНК-полимеразы числа копий нужной цепи секвенируемого ПЦР-фрагмента. Однако подобный подход применим только в специальных случаях секвенирования новых членов какого-либо семейства повторяющейся ДНК или гомологичных генов других организмов, поскольку предполагает наличие заранее клонированного участка такого фрагмента ДНК.
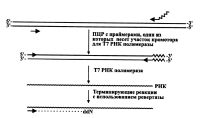
Интересен способ получения из двуцепочечного ПЦР-продукта одноцепочечной матрицы, пригодной для ее секвенирования обратной транскриптазой [Stoflet et al., 1988]. Особенностью этого метода является то, что матрица представляет собой РНК-копию ПЦР-фрагмента ДНК. Такое становится возможным благодаря специальному праймеру (одному из пары амплификационных), несущему, кроме комплементарной последовательности к секвенируемому фрагменту ДНК, участок промотора фагов Т7, или ТЗ, или SP6 [Lind et al., 1996]. Таким образом, после завершения самой ПЦР в реакционную смесь добавляется фермент Т7 РНК-полимераза, способная за короткий промежуток времени наработать значительное число молекул РНК, представляющих собой, в данном случае, матрицы для секвенирования (рис. 3.4).
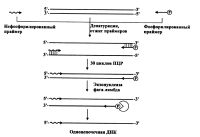
Другой ферментативный подход к созданию одноцепочечной матрицы заключается не в построении, а наоборот, в удалении одной из цепей ДНК (рис.). Известно, что экзонуклеаза фага лямбда разрушает цепь ДНК в направлении 5' → 3', однако для проявления этой ее активности 5'-конец цепи ДНК должен нести остаток фосфорной кислоты. Так, использование во время амплификации фосфорилированного праймера (одного из пары) позволило затем с помощью экзонуклеазы фага лямбда удалить эту фосфорилированную цепь ПЦР-фрагмента ДНК [Higuchi, Ochman, 1989; Takagi et al., 1993; Berg, Olaisen, 1994].
Удаление одной цепи ПЦР-продукта с помощью экзонуклеазы III [Ward et al., 1989] основано на факте возможной защиты другой цепи тиопроизводным дНТФ, которое данный фермент "не узнает" [Putney et al., 1981]. Такая защита одной цепи ПЦР-продукта достигалась путем его расщепления какой-либо подходящей рестрикционной эндонуклеазой и последующим ферментативным действием Кленовского фрагмента ДНК-полимеразы в присутствии трех обычных дНТФ и одного тио-дАТФ. Однако необходимо отметить, что данный способ применим далеко не всегда и, главным образом, из-за ограничений, вызванных самой нуклеотидной последовательностью амплифицируемого фрагмента ДНК. В другой работе сообщается об использовании для удаления одной из цепей фрагмента ДНК экзонуклеазы, кодируемой геном 6 фага Т7 и успешном проведении затем ПЦР-секвенировании [Somers et al., 1998].
Один из предложенных способов отделения одной цепи от другой для ПЦР-наработанных фрагментов ДНК, получивший в дальнейшем серьезное развитие, заключался в аффинной хроматографии полученных продуктов на колонке со стрептавидин-агарозой [Mitchell, Merril, 1989]. Такое становилось возможным благодаря использованию при амплификации ДНК биотинилированного праймера, поскольку в результате дальнейшей элюции с такой колонки с использованием 0,2 N NaOH как элюента происходила денатурация ДНК и выход биотиннесо-держащей цепи ДНК. Что касается биотинилированной цепи ДНК, то она в этом случае оказывалась прочно связанной со стрептавидином и оставалась в колонке. Таким образом, из двух цепей ДНК только одна оказывалась доступной для секвенирования и "виновата" в этом была так называемая твердая фаза в виде не совсем удобной стрептавидин-агарозы.
| "ЭБНБ" >> "П" >> "ПР" >> "ПРЯ" |
Статья про "Прямое секвенирование пцр-продукта" в Энциклопедии БНБ была прочитана 7277 раз
| Пицца в сковороде |
| Ананасы на гриле |
TOP 15
- Вши и борьба с ними
- Пижма обыкновенная
- Каштан конский обыкновенный
- Роль элементов в жизни растений
- Пшеница
- Иван-чай узколистный
- Календула лекарственная
- Обеззараживание химическими средствами
- Клевер луговой
- Дезинфекция текущая
- Душица обыкновенная
- Бессмертник песчаный
- Как устроены растения
- Морфологические признаки почвы
- Хвощ полевой