


БНБ
"ЭБНБ" (14252)
- Photogallery
- Естественные науки - Математика - Технология
- Авиация и машиностроение
- Высокие технологии
- Вычислительная техника
- Нанотехнология
- Роботехника
- Энергетика
- Электроника
Мечение новосинтезируемой цепи днк
Определение "Мечение новосинтезируемой цепи днк" в ЭБНБ
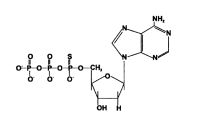 |
| Структурная формула тиопроизводного дНТФ |
 |
| Мечение новосинтезируемой цепи ДНК |
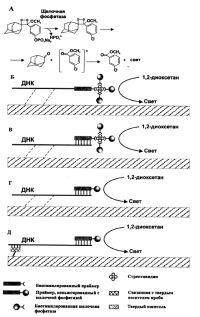 |
| Схема выявления полос ДНК |
В настоящее время существует три основных подхода к введению радиоактивной метки в растущую цепь ДНК, показанных на рис. Первый классический подход [Sanger et al., 1977a] заключается в проведении терминирующих реакций с дидезоксинуклеотидтрифосфатами и одновременном включении радиоактивной метки в виде одного из четырех дНТФ, присутствующего в реакционной смеси наряду с его намеченным вариантом. К недостаткам этого способа можно отнести конкуренцию между "горячим" и "холодным" дНТФ и подбор соответствующих концентраций и того и другого предшественника для достижения оптимального результата и, как следствие, необходимость присутствия в реакционной смеси довольно значительного количества радиоактивного дНТФ, достигающего 20 мкКи и более. Другим отрицательным моментом являлось то, что более протяженные фрагменты несли большее количество радиоактивной метки, чем короткие, и результатом была разная интенсивность полос ДНК на радиоавтографе в нижней и верхней частях одного и того же геля и, как следствие, невозможность достоверного прочтения иногда части нуклеотидной последовательности. Это заставляло в подобных случаях прибегать к повторному этапу радиоавтографии соответственно с увеличенным или уменьшенным временем экспозиции геля на рентгеновскую пленку. (Разная интенсивность полос в нижней и верхней частях радиоавтографа зависит и от многих других причин, рассматриваемых в следующем разделе.)
Этих недостатков практически полностью был лишен предложенный Табором и Ричардсоном вариант данного подхода, заключающийся в разделении этапов мечения и терминирования [Tabor, Richardson, 1987а]. В этом случае праймер, отожженный на матрице ДНК, удлинялся высокопроцессивной ДНК-полимеразой секвеназой в присутствии очень низких концентраций трех немеченных дНТФ и четвертого меченного в течение короткого промежутка времени и не при оптимальной температуре инкубации для фермента. Таким образом, происходило лишь весьма незначительное удлинение праймера и за счет включения во все молекулы ДНК приблизительно равного количества меченых нуклеотидов достигалась равная интенсивность полос по всей длине геля. (В то же время интенсивность полос в нижней и верхней частях геля зависит, главным образом, от соотношения дНТФ/ддНТФ в терминирующей реакции, что будет детально рассмотрено в следующем разделе.) Однако такое "квазиконцевое" мечение имеет свои особенности. Так, при подобном мечении большое значение приобретает уже не соотношение "горячего" и "холодного" дНТФ, а концентрация трех немеченных дНТФ, присутствующих в реакционной смеси или, еще точнее, соотношение их концентраций с общим количеством матрицы ДНК с "отожженным" на ней праймером. Ввиду высокой скорости полимеризации секвеназы при достаточных концентрациях дНТФ цепь ДНК может удлиниться на весьма значительное расстояние и в связи с этим первые нуклеотиды уже невозможно секвенировать и поэтому требуется уменьшенная концентрация дНТФ. В то же время, если в эксперименте предполагается осуществлять "чтение" фрагмента ДНК в диапазоне от 300 до 800 нуклеотидов, то значительное удлинение и одновременно мечение цепи ДНК даже обоснованно. Выделение мечения новосинтезируемой цепи ДНК в отдельный этап обычно характерно при секвенировании секвеназой, Taq ДНК-полимеразой или Bst ДНК-полимеразой, то есть ферментами с высокой скоростью полимеризации, однако была показана принципиальная возможность использования такого способа и для Кленовского фрагмента ДНК-полимеразы I [Краев, Миронов, 1990].
Возможность получения квазиконцевых меченых фрагментов ДНК в циклическом секвенировании ДНК путем ограниченной элонгации праймера Taq ДНК-полимеразой также была показана [Samols, Fuller, 1995]. Поскольку секвенируемая молекула ДНК в реакционной смеси при циклическом секвенировании представлена обычно в весьма низкой концентрации, то даже незначительные концентрации всех четырех дНТФ приведут к образованию в первых же циклах мечения довольно протяженных молекул, что совсем нежелательно. В связи с этим на этапе мечения в реакционную смесь добавляется всего 3 дНТФ, один из которых несет метку. При этом необходимо знать хотя бы небольшой участок нуклеотидной последовательности, следующей за местом отжига праймера, что позволит выбрать три наиболее подходящие дНТФ (и в том числе меченый), а также исключить определенный дНТФ. По завершению 30 циклов, в результате которых происходит незначительная (9 нуклеотидов в цитируемой работе) элонгация праймера, он оказывается меченым и после разделения на четыре соответствующие пробирки, содержащие конкретный ддНТФ, может быть готов к дальнейшему использованию в качестве затравочной молекулы в циклическом секвенировании. Подобный подход был осуществлен и ранее, однако в реакционную смесь добавлялся только меченый нуклеотид, что приводило к удлинению праймера всего на одно звено и он из 20-членного становился 21-членным [Kim, Kim, 1994]. Подобное мечение/удлинение праймера в цитируемой работе проводилось всего в течение 8 циклов и затем добавлялись соответствующие количества дНТФ/ддНТФ.
Независимо от используемой ДНК-полимеразы на этапе терминации уже меченых фрагментов ДНК в реакционной смеси также продолжает присутствовать тот же радиоактивно меченный предшественник и при этом происходит, хотя и со значительно меньшей эффективностью (из-за существенного уменьшения концентрации данного "горячего" дНТФ по сравнению с его немеченным вариантом), случайное включение в строящуюся цепь ДНК радиоактивного дНМФ. Это дает основание считать такое квазиконцевое мечение растущей цепи ДНК не самостоятельным подходом к мечению цепи ДНК, а лишь вариантом внутреннего мечения. В то же время в некоторых обзорах мечение новосинтезируемой цепи ДНК этим способом считают как самостоятельный подход к мечению, что, впрочем, лишено особых оснований, поскольку при этом способе сохраняется, как уже отмечалось выше, теоретическая возможность включения радиоактивной метки и на этапе терминации на всем протяжении строящейся цепи ДНК.
Второй самостоятельный подход к мечению новосинтезируемой цепи ДНК состоит в использовании в качестве затравки уже меченого олигонуклеотидного праймера, что также приводит к одинаковой интенсивности мечения всех фрагментов ДНК, не зависящее от их длины. Детальное исследование особенностей применения для секвенирования ДНК праймеров, меченных по 5'-концу радиоактивным фосфором с помощью γ-АТФ и полинуклеотидкиназы, проведено МакГроу [McGraw, 1984]. Хотя в литературе встречаются и более ранние упоминания об использовании при ферментативном секвенировании ДНК меченых праймеров [Hong, 1982]. К недостаткам этого способа можно отнести наличие лишь единичного атома радионуклида в каждом секвенируемом фрагменте ДНК, тогда как в предыдущих вариантах мечения количество включаемой метки было в несколько раз выше. Как следствие, меченные таким способом секвенируемые фрагменты ДНК требовали, как правило, большее время экспозиции. Другим недостатком можно считать необходимость проведения дополнительного предварительного этапа мечения с использованием другого фермента Т4 полинуклеотид-киназы, тогда как при мечении описанными выше способами все происходило в одной реакционной пробирке с использованием одного и того же фермента ДНК-полимеразы как для мечения, так и для дальнейшего построения цепи ДНК в условиях специфического терминирования. Некоторым положительным моментом такого мечения по 5' -концу является то, что при имеющем место радиолизе происходит разрыв цепи ДНК в участке, расположенном преимущественно поблизости от включенного радионуклида, а поскольку радиоактивная метка при таком способе мечения локализована только на 5'-конце цепи ДНК, то? следовательно, будут образовываться достаточно короткие фрагменты ДНК, продолжающие нести радиоактивную метку на своем 5'-конце. Результатом этого будет некий повышенный фон только в нижней части геля, тогда как при использовании квазиконцевого и/или внутреннего мечения могут образовываться радиоактивно меченные неспецифические обрывки новосинтезированных цепей ДНК довольно крупного размера, что неминуемо приведет к увеличенному фону на протяжении значительной части геля. (Отрицательный вклад радиолиза можно избежать, разделяя секвенирующим гель-электрофорезом свежеполученные продукты терминирующих реакций и не прибегая к их длительному хранению. В то же время следует отметить, что препараты ДНК, меченные более низкоэнергетическими радионуклидами 33Р или 35S, могут храниться значительно дольше, чем таковые после их мечения 32Р.) Все эти описанные выше способы мечения новосинтезируемой цепи ДНК объединяет то, что они имеют один общий существенный недостаток, заключающийся в том, что на радиоавтографе геля детектируются все радиоактивные фрагменты, будь то специфически терминированные молекулы ДНК соответствующими ддНМФ или являющиеся артефактами построения комплементарной цепи ДНК. Известно, что наряду с терминацией строящейся комплементарной цепи, происходящей при включении дидезоксипроизводных нуклеотидов, среди продуктов терминирующих реакций всегда присутствуют фрагменты ДНК, не несущие на своем 3'-конце соответствующего ддНМФ. Последнее происходит по целому ряду причин, главными из которых могут считаться низкое качество матрицы ДНК, вызванное ее плохой очисткой, либо сильная вторичная структура какого-либо участка секвенируемой ДНК. ДНК-полимераза не может эффективно "пройти" эти участки ДНК и в результате на заключительном радиоавтографе секвенирующего геля в этих местах образуются "нечитаемые" полосы, называемые "стопами" или BAFLs (Bands in All Four Lanes), которые присутствуют в нескольких или сразу во всех четырех дорожках. Для того чтобы избежать эти нежелательные события, разработан целый ряд всевозможных улучшений проведения терминирующих реакций, которые подробно будут рассматриваться в следующем разделе. Однако оказалось, что нежелательный эффект выявления все же возникающих "стопов", а также исключение просто высокого фона, который может иметь место за счет неспецифической терминации, затрудняющего "чтение" или делающего его невозможным, можно избежать и на стадии мечения благодаря недавно появившемуся третьему подходу к получению меченых фрагментов ДНК.
Заметного повышения качества ферментативного секвенирования ДНК ручным методом удалось добиться за счет способа мечения растущей цепи ДНК с помощью ддНТФ, несущих радиоактивную метку 33Р в остатке фосфорной кислоты, расположенной в ос-положении [Fan et al., 1996; Brummet et al., 1997]. Так, в случае произошедшего неспецифического терминирования растущей комплементарной цепи ДНК на ее 3'-конце будет находиться какой-либо нерадиоактивный дНМФ. В случае использования любого из описанных выше способов мечения данный секвенируемый фрагмент ДНК все равно будет нести метку и на заключительном радиоавтографе ему будет принадлежать соответствующая полоса. Однако, если в качестве метки используются [α-33Р] ддНТФ, то неспецифически терминированный фрагмент ДНК, не несущий на своем 3'-конце соответствующего [α-33Р] ддНМФ, на радиоавтографе выявлен не будет.
Как и в случае с использованием меченого праймера, каждая молекула секвенируемого фрагмента ДНК будет нести только единственную метку в виде ддНМФ на своем 3'-конце. Из этого следует, во-первых, что время экспозиции такого секвенирующего геля с мечеными дидезокситерминаторами будет также несколько увеличено, во-вторых, количество радиоактивной метки, присутствующей в реакционной смеси, может быть уменьшено до всего 1 мкКи (против 20 или 5 мкКи для [α-33Р] дНТФ, необходимых для их включения в строящуюся цепь ДНК разными описанными выше способами), что позволяет обращаться со значительно меньшим количеством радиоактивного материала.
Обычно перед нанесением продуктов секвенирующих реакций на полиакриламидный гель не требуется удаления невключившейся радиоактивной метки, ввиду того, что благодаря своему относительно малой молекулярной массе γ-АТФ, α-дНТФ или α-ддНТФ будут двигаться значительно быстрее фрагментов ДНК и на заключительном радиоавтографе будут не видны. Однако в случае использования флуоресцентно меченных ддНТФ повышение уровня фона может быть заметным и рекомендуется удаление непрореагировавшей метки. Был предложен довольно простой и быстрый способ удаления метки с помощью смолы Wizard, выпускаемой фирмой "Promega" (США) [Kaczorowski, Sektas, 1996].
В литературе встречается упоминание об использовании в секвени-ровании ДНК в качестве метки стабильного изотопа 57Fe [Jacobson et al., 1991]. Авторы специально синтезировали органический компаунд ферроцен, несущий изотоп 57Fe и присоединили его к 5' -концу олигонуклеотидного праймера. В модельном эксперименте с помощью радиоактивной квазиконцевой метки, включаемой секвеназой, они продемонстрировали принципиальную возможность построения комплементарной цепи ДНК с такого 57Ре-содержащего праймера и при этом подвижность таких железосодержащих фрагментов ДНК замедлялась совсем незначительно. По мнению авторов цитируемой статьи, гораздо больший интерес в качестве метки для секвенирования ДНК представляет олово, поскольку оно имеет сразу 10 стабильных изотопов. Получение большинства из них в высокоочищенном виде позволит проводить мультиплексное секвенирование, поскольку каждый изотоп может детектироваться независимо. Однако серьезным ограничением для широкого использования данного подхода секвенирования ДНК с помощью стабильных изотопов является необходимость детекции, разделенных гель-электрофорезом полос ДНК с помощью дорогостоящего оборудования, каковым является обладающий очень высокой чувствительностью резонансный ионизационный масс-спектрометр. Учитывая высокую скорость анализа, авторы цитируемой статьи подсчитали, что данный подход теоретически может обеспечить "чтение" 1,44 х 107 полос секвенируемой ДНК в сутки. Дальнейшее развитие подхода в секвени-ровании ДНК с использованием стабильных изотопов олова получило в другой работе этих авторов [Arlinghaus et al., 1997], более подробно рассматриваемой в главе, посвященной методу секвенирования ДНК гибридизацией.
Желание экспериментаторов хоть как-то оградить себя от вредного воздействия радиоактивности повлекло за собой выявление полос ДНК как колориметрическими, так и хемилюминесцентными методами. Однако эффективное проведение таких реакций возможно только с фрагментами ДНК, сорбированными на поверхности какого-нибудь твердого носителя, а не находящимися внутри полиакриламидного геля. Чисто технические трудности переноса фрагментов ДНК из секвенирующего полиакриламидного геля на нейлоновые, нитроцеллюлозные или какие-то другие мембранные фильтры заметно сдерживали развитие этого подхода. Разработка специальных приборов для секвенирующего электрофореза с одновременным переносом выходящих фрагментов ДНК из нижнего среза геля на находящийся в соприкосновении с ним движущийся мембранный фильтр заметно упростила процедуру переноса (более подробно такие приборы вместе с особенностями переноса фрагментов ДНК, а также другие способы переноса рассмотрены в главе, посвященной электрофоретическому разделению секвенируемых фрагментов ДНК).
Для выявления перенесенных из полиакриламидного геля на мембранный фильтр полос ДНК колориметрическим методом с помощью красителей нитротетразолиевого голубого и 5-бромо-4-хлоро-3-индо-лилфосфата необходимо введение особой метки в строящуюся комплементарную цепь ДНК. Наиболее широкое применение нашли олигонуклеотидные праймеры, несущие на своем 5'-конце молекулу биотина или дигоксигенина [Beck, 1987; Pohl, Maier, 1995]. Для получения внутренне меченных молекул ДНК обычно используется дУТФ, меченный биотином или дигоксигенином [Pohl, Maier, 1995].
Биотин (витамин Н) образует прочные комплексы с авидином или стрептавидином и находит благодаря этому широкое применение в молекулярной биологии [Wilchek, Bayer, 1988]. Дигоксигенин, являющийся стероидным соединением растения наперстянки, используется также достаточно широко. В случае с дигоксигениновой меткой дальнейшая схема выявления полос заключается во взаимодействии фрагментов ДНК после их разделения секвенирующим гель-электрофорезом и переноса на мембранный фильтр с конъюгатом щелочная фосфатаза/ан-титела к дигоксигенину. Для биотинмеченных фрагментов ДНК требуется инкубация в растворе конъюгата стрептавидин/щелочная фосфа-таза. Таким образом, после той или иной процедуры каждая полоса ДНК на мембранном фильтре несет щелочную фосфатазу и после непродолжительной инкубации (менее 1 ч) в указанных выше красителях за счет отщепления под действием данного фермента остатка фосфорной кислоты начинают проявляться полосы, имеющие синюю окраску. Для развития окраски слабых полос может потребоваться более продолжительное время - до 24 ч. Следует отметить достаточно высокую трудоемкость метода при тщательном проведении всех этих этапов, поскольку требуются многочисленные инкубации в блокирующих и прочих растворах и последующие отмывки, предшествующие стадии проявления окрашивания. Другим недостатком является то, что при хранении мембранных фильтров с проявившимися на них полосами ДНК красители на свету имеют тенденцию к выцветанию. И, наконец, главный недостаток метода заключается в его не очень высокой чувствительности при выявлении полос ДНК, значительно уступающей радиоактивному.
Применение другого субстрата, такого как 1,2-диоксетан, хемилюминесценцию которого также вызывала обработка щелочной фосфатазой, показало его высокую чувствительность и пригодность для молекулярно-биологических целей [Schaap et al., 1987]. Так, выявление полос ДНК, меченных биотином или дигоксигенином, с применением той же щелочной фосфатазы, конъюгированной со стрептавидином или с антителами к дигоксигенину, соответственно с помощью хемилюминесцентного субстрата 1,2-диоксетана, называемого еще AMPPD (полное название которого 3-(2'-спироадамантан)-4-метокси-4-(3''-фосфорилокси) фенил-1,2-диоксетан) (рис.), по чувствительности вполне сравнимо с радиоактивной меткой. Однако трудоемкость выполнения подготовительных процедур весьма высока, поскольку аналогична таковой при колориметрическом окрашивании [Beck et al., 1989; Tizard et al., 1990; Cate et al., 1991; Chee, 1991; Creasey et al., 1991; Holtke et al., 1992; Debuire et al., 1993]. Указанное выше соединение AMPPD весьма стабильно и может храниться на протяжении даже нескольких лет, но при удалении под действием щелочной фосфатазы остатка фосфорной кислоты, выступающего в качестве заместителя, происходит быстрая декомпозиция этого соединения с выделением квантов света, для регистрации которых может быть применена обычная рентгеновская пленка. AMPPD имеет довольно низкий квантовый выход (1,3x10-5), что требует декомпозиции 77000 молекул для генерации одного фотона [Beck, Koster, 1990]. В связи с этим фирма "Tropix, Inc." (США) стала производить специальные энхансеры "Сапфир", "Изумруд" и "Рубин", отличающие соответственно длиной волны эмиссии и производящие усиление сигнала в 10-500 раз. Однако проведенное специальное исследование по их применению в секвенировании ДНК показало неважные результаты, главным образом, из-за неравномерного распределения этих соединений по поверхности мембранного фильтра [Cate et al., 1991]. Детальное рассмотрение свойств 1,2-диоксетана и его производных, а также применение в молекулярной биологии системы диоксетан/щелочная фосфатаза проведено в обзоре Бека и Костера [Beck, Koster, 1990].
Позднее было получено другое производное диоксетана - CSPD (3-(4-метокси-спиро[1,2-диоксетан-3,2'-(5'-хлоро)-трицикло [3.3.1.1.3,7] декан]-4-ил) фенил фосфат), характеризующееся улучшенным квантовым выходом, и с успехом применено в качестве субстрата для щелочной фосфатазы при секвенировании ДНК [Olesen et al., 1993]. В этой же работе продемонстрирована возможность использования в качестве метки как биотина для системы стрептавидин/щелочная фосфата, так и различных гаптенов (дигоксигенина, 2,4-динитрофенила и флуоресцеина) за счет формирования комплексов антител к этим соединениям/щелочная фосфатаза с целью их дальнейшего выявления 1,2-диоксетаном. При этом оказалось, что чувствительность детекции для системы биотин-стрептавидин/щелочная фосфатаза в 8 раз выше по сравнению с таковой для флуоресцеина и в 16 раз - по сравнению с дигоксигенином и 2,4-динитрофенилом [Olesen et al., 1993]. Поскольку цитируемая работа была посвящена возможностям мультиплексного секвенирования, то авторы используемый ими подход вполне справедливо назвали мультиплексным мечением в связи с измененной схемой этого подхода.
Особо следует отметить очень короткое время экспозиции, обычно составляющее от 1 до 30 мин против 12-24 ч для радиоактивной метки, что послужило дополнительным основанием для использовании диоксетановой химии при проведении мультиплексного секвенирования [Beck et al., 1989; Gillevet, 1990; Olesen et al., 1993]. Несколько позже, чтобы облегчить труд экспериментаторов, фирмой "Hoefer Scientific Instruments, Inc.*' (США) стал выпускаться даже специальный прибор, позволяющий автоматически проводить все необходимые процедуры по образованию комплекса ДНК-биотин/стрептавидин-щелочная фосфатаза и заключительному этапу декомпозиции диоксетана [Patel, Nash, 1995].
В настоящее время при секвенировании ДНК также широко применяются различные флуоресцентные красители, однако детекция такой ДНК предполагает наличие сложного дорогостоящего оборудования, каковыми являются автоматические секвенаторы ДНК и поэтому подробное рассмотрение флуоресцентных меток будет проведено в специальной главе, посвященной автоматическому секвенированию ДНК.
Хотя и данный раздел имеет целью описать существующие способы внесения радиоактивной или какой-либо прочей метки во вновь синтезируемую цепь ДНК, секвенирование ДНК, не несущей никакой метки, также возможно, а поскольку метка служит для выявления фрагментов ДНК после их разделения в секвенирующем геле, то упоминание или даже краткое описание в данном разделе подходов к секвенированию ДНК, где процедуры по ее детекции проводятся по завершению электрофореза, вполне логично.
Так, фрагменты ДНК, разделяемые с помощью гель-электрофореза при мультиплексном секвенировании, на первый взгляд, не несут какой-то ставшей уже привычной метки, однако определенная последовательность нуклеотидов вектора(ов), предшествующая вставке, может рассматриваться как своеобразная метка, в сущности таковой и являющаяся. А вот при секвенировании ДНК с последующей визуализацией полос в полиакриламидном геле с помощью окрашивания серебром [Wade-Evans, 1996], действительно, можно считать ДНК немеченной. Разработанный высокочувствительный и относительно простой метод окрашивания серебром фрагментов ДНК в полиакриламидном геле [Bassam et al., 1991] позволил выявлять весьма незначительные количества молекул ДНК, сравнимые с теми, которые обычно разделяются секвенирующим электрофорезом. Проведение соответствующих процедур после завершения электрофоретического разделения не занимает много времени и уже через 90 мин можно "читать" последовательность нуклеотидов ДНК с окрашенного серебром геля. Однако из-за высокой чувствительности метода к различным загрязнениям необходимо исключить отпечатки пальцев на геле и поэтому все операции рекомендуется проводить в перчатках. К другим обязательным требованиям следует отнести точное выполнение всех стадий, включая их временные интервалы и температуру применяемых растворов, высокую чистоту используемых реагентов и тщательно вымытые стекла для геля, причем, как указывает производитель специального набора для секвенирования ДНК с помощью серебряного окрашивания (Promega, США), некоторые детергенты приводят к увеличению общего фона геля. К недостаткам метода можно отнести то, что обычно выявляемые полосы ДНК видны на геле, приклеенном к стеклу с помощью γ-метакрилоксипропилтриметоксисилана, долговременное хранение которого (стекла с гелем) просто неразумно. Так как обращение с гелем такого большого размера при окрашивании серебром весьма затруднительно, то некоторой альтернативой стеклу может быть специальная Gel-Fix пленка для фиксирования на ней полиакриламидного геля, пригодная и для хранения на ней высушенного геля. В то же время фирма "Promega" поставляет специальную пленку EDF (Electrophoresis Duplicating Film), на которой с помощью кратковременного освещения окрашенного серебром геля можно получить постоянный отпечаток.
| "ЭБНБ" >> "М" >> "МЕ" >> "МЕЧ" |
Статья про "Мечение новосинтезируемой цепи днк" в Энциклопедии БНБ была прочитана 5053 раз
| Бургер двойного помола |
| Луковый соус |
TOP 15
- Вши и борьба с ними
- Пижма обыкновенная
- Каштан конский обыкновенный
- Роль элементов в жизни растений
- Пшеница
- Иван-чай узколистный
- Календула лекарственная
- Обеззараживание химическими средствами
- Клевер луговой
- Дезинфекция текущая
- Душица обыкновенная
- Бессмертник песчаный
- Как устроены растения
- Морфологические признаки почвы
- Хвощ полевой