


БНБ
"ЭБНБ" (14252)
- Photogallery
- Естественные науки - Математика - Технология
- Авиация и машиностроение
- Высокие технологии
- Вычислительная техника
- Нанотехнология
- Роботехника
- Энергетика
- Электроника
Затравочные молекулы для пцр
Определение "Затравочные молекулы для пцр" в ЭБНБ
 |
| Часть нуклеотидной последовательности |
 |
| Димеры олигонуклеотидных праймеров |
 |
| Внутримолекулярная структура праймера |
 |
| Нуклеотидная последовательность сплинкера |
 |
| Схема отжига праймеров |
 |
| Схема формирования праймера |
 |
| Схема отжига встык |
 |
| Схема использования октамерных олигонуклеотидов |
Нуклеотидная последовательность фрагмента ДНК, в пределах которой предполагается выбрать участок для синтеза праймера, должна быть уверенно "прочитана". Следует исключить сомнительные последовательности, допускающие их неоднозначное "прочтение". Преследуя цель синтеза минимального количества праймеров, необходимых для завершения определения нуклеотидной последовательности протяженного фрагмента ДНК, надо располагать новый праймер возможно близко к 5'-концу уже известной последовательности, но, как правило, чтобы его 3'-конец находился не ближе 20-50 нуклеотидов от края. Конкретное расположение места для отжига праймера во многом зависит и от особенностей самой последовательности ДНК, где надо принимать в расчет и ее GC-состав, и возможные повторяющиеся элементы, и участки со значительной (потенциальной) вторичной структурой. Не последнюю роль при выборе праймера играет и температура отжига синтезируемых олигонуклеотидов, которая обычно рекомендуется в пределах 40°-50°С при предполагаемой использовании в качестве ДНК полимеразы секвеназы в 60°-70°С для термостабильных ДНК-полимераз. Кроме GC-состава, температура отжига праймеров в значительной степени зависит и от их длины, обычно выбираемой в пределах 15-22 нуклеотидов. Для более точного определения температуры плавления олигонуклеотидов в расчет принимаются не только сами основания, но и их ближайшее окружение, что может быть проведено с помощью специализированных компьютерных программ, подробнее рассмотренных в соответствующей главе. Однако грубый подсчет температуры плавления праймеров может быть проведен вручную с помощью следующей формулы:
Tm = 4°C(G + С) + 2°С(А + Т) - 5°С,
хотя, считается, что данная формула справедлива лишь для относительно коротких праймеров длиной до 20 звеньев.
В литературе встречаются рекомендации при выборе длины секвенирующих праймеров исходить из стандартной длины в 18 нуклеотидов для праймера с 50%-ным GC-составом и прибавляя по одному звену с понижением GC-состава на каждые два процента [Gerischer, Durre, 1993]. В то же время эти авторы сообщают об успешном применении различных 17-мерных праймеров, с содержанием G- и С-нуклеотидов от 2 до 9 для секвенирования АТ-богатого генома Clostridium aceto-butylicum [Gerischer, Durre, 1990, 1993].
Исходя из теории вероятности встречаемости отдельных участков нуклеотидной последовательности разной протяженности в ДНК, можно считать, что уже 15-мерный праймер будет (при условии его 100%-ной гомологии с мишенью) уникальным для генома человека, оцениваемого обычно в 3х109 пн. Вторым условием является непринадлежность данного олигонуклеотида к каким-либо повторяющимся элементам генома. Таким образом, вероятность фальш-праймирования данными олигонуклеотидами такой протяженности с какого-то другого места генома крайне низка. В то же время нельзя не учитывать возможность отжига праймера с не полностью спарившимися основаниями, что как раз может привести к фальш-праймированию. Чтобы хоть как-то уменьшить вероятность этого, необходимо провести анализ уже известной последовательности секвенируемого фрагмента ДНК и самого вектора, уделяя максимальное внимание выявлению участков 100%-ной гомологии с последними 5-7 нуклеотидами праймера на его 3'-конце. В случае все же "нечитаемого" радиоавтографа геля, ввиду наличия в матрице ДНК дополнительных мест отжига праймера, повышение температуры отжига праймера теоретически может помочь преодолеть эту проблему. В противном случае необходимо синтезировать новый праймер с другой последовательностью.
Весьма опасным может быть формирование шпилечных структур внутри самого праймера и образование димеров праймеров, 3'-концы которых образуют прочные связи. Примеры таких праймеров приведены ниже на рис.
Как видно из рис., для праймера А характерно значительное присутствие комплементарных нуклеотидов на 3'-конце. По всей вероятности для части праймерных молекул (этот процесс не относится к абсолютно количественным и даже при одной и той же температуре олигонуклеотиды могут существовать в разных вариантах) такая структура может сохраниться во время этапа отжига и, таким образом, определенное количество праймера будет не способно служить в качестве затравки для ДНК-полимеразы. Так, для первого праймера существуют различные варианты образования димерных молекул, два из которых (А1 и А2) характеризуются достаточно прочной структурой, чтобы существовать в растворе во время этапа отжига данного олигонуклеотида на матрице ДНК. Результатом этого могут явиться более слабые сигналы с радиоавтографа геля. Что касается варианта A3, то его существование крайне маловероятно. Для праймера Б, незначительно отличающегося по своей последовательности от праймера А, приведенные возможные димеры при температуре отжига, скорее всего, существовать не будут.
Кроме образования димеров, для праймера А возможно предсказать образование внутримолекулярной шпилечной структуры, изображенной на рис. Такая достаточно прочная структура также способна исключить часть праймера из реакции отжига на матрице ДНК и соответственно ухудшить конечные результаты.
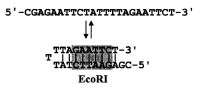
Особый тип праймеров для секвенирования ДНК представляет собой короткая двуцепочечная молекула ДНК, состоящая из двух комплементарных олигонуклеотидов, сконструированных так, что при их отжиге друг на друга образуется несколько выступающих нуклеотидов (обычно 4 или 5) на 3'- или 5'-конце. Данная короткая молекула ДНК за счет образующегося таким образом так называемого липкого конца при помощи ДНК-лигазы лигируется с комплементарным ему концом матрицы ДНК, образованным под действием соответствующей рестрикционной эндонуклеазы. В дальнейшем участок самого лигированного олигонуклеотида служит местом для отжига секвенирующего праймера (которым может быть один из данных комплементарных олигонуклеотидов) [Furuyama et al., 1994]. В другом варианте при лигировании праймерной двуцепочечной молекулы ДНК специально формируется "ник" на границе этих фрагментов ДНК, с которого и начинается построение новой цепи или за счет смещения прежней цепи ДНК или ее удаления 5' → 3'-экзонуклеазной активностью ДНК-полимеразы [Fu et al., 1995; 1997]. Также было найдено интересное решение по объединению в одной молекуле праймера и линкера, получившего название сплинкер (splinker - sequencing primer linker) [Kalisch et al., 1986]. Особенностью такого сплинкера было то, что его последовательность содержала внутренний участок гомологии, что при определенной температуре приводило к формированию вторичной структуры в виде "шпильки" с выступающим или тупым концами.
Из рис. на котором приведен пример такого сплинкера, видно, что данный олигонуклеотид может существовать также и в форме "шпильки" с выступающим на 5'-конце нуклеотидами, пригодными для их лигирования с подобными же. Необходимым элементом сплинкера является наличие в его двуцепочечном участке доступного сайта узнавания относительно редкошепящей рестрикционной эндонуклеазы, позволяющей на определенном этапе удалить концевую петлю.
Даже самый малый (обычный) масштаб синтеза олигонуклеотидов в 0,05 мкмоль (существуют синтезаторы с масштабом синтеза и 0,03 мкмоль) позволяет синтезировать в тысячи раз превышающее количество олигонуклеотидов, используемых в качестве затравки в реакциях секвенирования. Остаток праймера, как правило, больше нигде не применяется, что крайне не экономно. Данное обстоятельство заставляло искать какие-то новые варианты стратегии секвенирования ДНК праймерной "прогулкой".
Весьма существенное влияние на дальнейший процесс совершенствования праймеров для секвенирования протяженных фрагментов ДНК праймерной "прогулкой" оказала статья Штудиера [Studier, 1989], в которой впервые говорится о необходимости существования предсинтезированной библиотеки олигонулеотидных праймеров. В данной статье был проведен подробный анализ теоретически возможных частот встречаемости праймеров разной длины в случайной ДНК, клонированной в космидах. (Под случайной ДНК здесь понимается ДНК с приблизительно равным соотношением всех четырех нуклеотидов в одной цепи и не содержащей блоков каких-либо простых повторов.) Были проанализированы праймеры длиной от 6 до 12 нуклеотидов и показано, что 8-мерные праймеры вполне пригодны для их использования в качестве затравок, тогда как ранее считалось, что секвенирующий праймер должен быть не короче 15-17 нуклеотидов. Что касается 6- или 7-мерных праймеров, то они также могут служить в качестве затравок, но для них, как правило, имеются множественные участки отжига на анализируемой в цитируемой работе рекомбинантной космиде (общей длиной около 45 тпн) и поэтому такие короткие праймеры не пригодны для целей секвенирования. Вероятность наличия уникальных единичных сайтов в рекомбинантной космиде для окта-, нона- и декамеров значительно выше и, исходя из этого, Штудиер предположил, что существование библиотеки из 5900 октануклеотидных, 8400 нонануклеотидных и 26000 декануклеотидных праймеров будет вполне достаточным для осуществления проекта секвенирования генома человека. Экономический расчет показал, что стоимость таких праймеров будет составлять очень незначительную долю стоимости всего процесса секвенирования ввиду того, что для каждой секвенирующей реакции необходима 1/1000 или даже 1/10000 часть синтезированного праймера.
Однако синтез библиотеки праймеров такого размера все равно был невозможен и в связи с этим проводился более тщательный анализ секвенирующих праймеров на предмет сокращения их общего количества. Было продемонстрировано высокое качество секвенирования ДНК с использованием октануклеотидных праймеров [Burbelo, Iadarola, 1994]. Авторы считают, что нет необходимости в синтезе и применении для секвенирования рекомбинантной ДНК, клонированной в плазмидных векторах, полной библиотеки октамеров, состоящей из 65536 вариантов, а вполне можно обойтись 1000 вариантов, причем среди них не должно быть участков, гомологичных обычным векторным последовательностям, палиндромным участкам или праймеров с очень низким GC-составом.
Хотя и существует возможность праймирования ДНК гекса- и даже пентануклеотидными праймерами, они образуют множественные участки связывания с ДНК матрицы и поэтому как единичные праймеры не пригодны для секвенирования. Несмотря на то, что была показана принципиальная возможность использования в качестве затравки октануклеотидных праймеров, все же их частота встречаемости в случайной ДНК не позволяет считать их достаточно уникальными. В этом отношении нонамерные праймеры являются более предпочтительными и как показано рядом авторов, минимально возможно короткими для эффективного секвенирования ДНК. Однако, полная библиотека 9-мерных праймеров должна уже состоять из 262 144 различных вариантов (49) и содержать 2 359 296 нуклеотидных звеньев. Синтез такого количества праймеров нереален и поэтому ряд исследователей пошли по пути компьютерного анализа всех теоретически возможных вариантов 9-меров, с тем чтобы сильно ограничить число действительно пригодных и необходимых [Siemieniak, Slightom, 1990]. Так, этими авторами была предложена библиотека всего из 3342 нонамерных праймеров. Проведенный компьютерный анализ на предмет распределения всех этих праймеров по всей длине клонированных фрагментов ДНК крупного размера из генома человека с известными нуклеотидными последовательностями, имеющимися на тот момент в 63-м выпуске Генбанка, общей протяженностью около 800 тпн показал их довольно равномерное распределение и пригодность для секве-нирования ДНК с помощью подхода праймерной "прогулкой". Столь сильное ограничение числа нонамерных праймеров было достигнуто за счет ряда следующих требований предъявленных к этим праймерам. Так, предполагалось расположение на 3'-конце праймера G или С нуклеотидов и в соседней позиции А или Т нуклеотидов; общий GC-состав должен быть в пределах от 45 до 60%; не должно быть полинуклеотидных повторов (таких как А А, СС, GG, ТТ); не должно быть ди-нуклеотидных повторов (например, GCGCGCGC); и, наконец, праймер не должен быть гомологичен каким-либо коротким повторяющимся элементам, широко представленным в геномах различных организмов, как, например A/w-повторам. Разработанный компьютерный алгоритм с этими заложенными требованиями выдал последовательности 3342 нонамерных праймеров, удовлетворяющих всем этим условиям. Однако авторы признавали, что и этот размер библиотеки праймеров все же великоват. Позднее они ограничили размер подобной библиотеки праймеров до всего 2391 варианта, но при этом, к сожалению, не указали, за счет каких дополнительных ограничений им это удалось сделать [Slightom et al., 1994]. В этой работе авторы провели не только компьютерный анализ, но и осуществили определение нуклеотидных последовательностей двух клонированных фрагментов ДНК общей протяженностью около 15 тпн с помощью 59 праймеров из разработанной ими библиотеки в 2391 нонамерный праймер.
Другим подходом для секвенирования ДНК праймерной "прогулкой" с помощью коротких предсинтезированных праймеров явилось составление 12-, 18- или даже 24-членных праймеров из библиотеки гексануклеотидных фрагментов посредством их лигирования после отжига встык на одноцепочечной матрице ДНК (рис. 2.13) [Szybalski, 1990, 1993].
Серьезным преимуществом данного процесса, получившего название SPEL-6 (Sequential Primer Elongation by Ligation with 6-mers), стал относительно небольшой размер библиотеки гексануклеотидных праймеров, равный всего 46 = 4096. После низкотемпературного лигирования 6-меров на матрице ДНК и их превращения в полноразмерный праймер с этого участка шло построение новой цепи ДНК, тогда как при повышении температуры непролигировавшие 6-членныё фрагменты диссоциировали с матрицы ДНК. Еще меньшую библиотеку из всего 1024 гексануклеотидных праймеров удалось создать за счет использования вырожденных по одному нуклеотиду праймеров и успешно применить ее для секвенирования ДНК [Kaczorowskii, Szybalski, 1994]. Эти авторы показали, что 18-мерный (3 гексануклеотидных фрагмента) праймер формируется за 10 мин лигированием отожженных встык на матрице ДНК данных 6-меров. В дальнейшем этими же авторами был проведен детальный анализ условий лигирования и секвенирования ДНК с помощью SPEL-6 подхода [Kaczorowski, Szybalski, 1996a]. Было показано, что лигирование 6-членных праймеров носит кооперативный характер и лучшие результаты по секвенированию с помощью лигированных на матрице ДНК праймеров обнаружили 18-60 нуклеотидные праймеры, составленные из 3-10 гексамерных фрагментов. Более длинные праймеры позволили лучше преодолеть проблемы, связанные со вторичной структурой. Различная эффективность и некоторые особенности лигирования гексамеров выявились при использовании ДНК лигазы фага Т4 и термостабильной ДНК лигазы Rodothermus marinus. Так, Rm-лигаза требовала не менее 6 гексануклеотидных фрагментов, но при этом, как было выяснено, не нуждалась, в отличие от Т4 ДНК-лигазы, в SSB-белке. Последнее весьма важно, так как удаление этого, иногда добавляемого в реакцию и способствующего лигированию, белка [Kaczorowski, Szybalski, 1994] перед электрофоретическим разделением секвенируемых образцов представляет значительную проблему [Kaczorowski, Sektas, 1996].
Пригодность SPEL-6 подхода для автоматического секвенирования флуоресцентно меченной ДНК была продемонстрирована разными авторами [Hou, Smith, 1994; Johnson et al., 1996; Kaczorowski, Szybalski, 1996b; Lodhi, McCombie, 1996]. Интересно отметить, что последние авторы обнаружили высокую пригодность лигированных гексамерных праймеров для целей секвенирования ДНК праймерной "прогулкой" и только один такой лигированный праймер показал плохой результат. Контрольное секвенирование этого участка с помощью соответствующего обычного 18-мерного праймера, синтезированного в олигонуклеотидном синтезаторе, показало, что и он также оказался не способен однозначно определить последовательность этого участка ДНК (Lodhi, McCombie, 1996].
Был предложен интересный способ создания 12-, 18-, 24- или 30-мерных праймеров путем лигирования в растворе коротких гексамерных блоков с помощью Т4 или Т7 ДНК лигаз [Dunn et al., 1995]. Такие блоки для лигирования подбирались так, что каждый из них образовывал по три комплементарные пары оснований с двумя другими. Особенностью этого комплекса праймеров являлось то, что фосфатные группы на 5'-конце, необходимые для лигирования, несли лишь гексамерные блоки, располагающиеся на одной цепи. В результате лигирования и последующей денатурации образовывались полноценные 12-, 18-, 24- или 30-нуклеотидные праймеры и не пролигированные 6-меры от противоположной цепи (рис.). Авторы обнаружили, что более эффективное лигирование гексануклеотидов и формирование, например, 18-звенного олигонуклеотидного праймера за счет существующих стэкинг-взаимодействий происходит при условии образования шестью ге-ксамерами выступающих комплементарных концов, способных к отжигу друг с другом, приводящему к увеличению общей протяженности отрезка двуцепочечнои сегментированной ДНК. Ранее этой же группой исследователей был предложен способ создания сегментированного праймера из пула гексануклеотидных фрагментов путем их тандемного отжига на матрице ДНК [Kieleczawa et al., 1992].
Главным отличием от SPEL-6 подхода здесь явилось то, что гексануклеотидные фрагменты ДНК не лигировали между собой и они удерживались на матрице ДНК с помощью SSB-белка, а также за счет стэкинг-взаимодействий между соседними нуклеотидными основаниями из разных 6-меров (рис.). Независимо и почти одновременно с данной работой Улановским и соавт. было проведено детальное исследование особенностей праймирования ДНК с помощью так называемых модульных праймеров [Kotler et al., 1993]. Отдельными модулями служили пентамер-ные, гексамерные, гептамерные и октамерные праймеры. Используемые поодиночке пентамерные и гексамерные праймеры образуют множественные участки праймирования, однако они же в составе сегментированного праймера (например, 5 + 5 + 7 или 6 + 6 + 6 или 6 + 8) отжигаются в уникальных местах как если бы они представляли собой цельный праймер и вполне пригодны для секвенирования. Проявляющийся кооперативный эффект заключается в том, что для каждого модуля повышается температура ассоциации/диссоциации при наличии соседних праймеров-модулей. Авторам удалось исключить использование нежелательного SSB-белка и отдельные модули при этом взаимодействуют друг с другом за счет стэкинг-взаимодействия. Как известно, пурин-пуриновые взаимодействия прочнее вариантов с другими нуклеотидами и, таким образом, соседние модули, несущие в своих граничных участках пурины, в большей степени пригодны для секвенирования ДНК с помощью таких модульных праймеров. Две проанализированные этими авторами ДНК-полимеразы обнаружили некоторые различия при использовании одних и тех же модульных праймеров в качестве затравок. Дальнейшее развитие семейство модульных праймеров получило в следующей работе этой же группы авторов [Kotler et al., 1994]. В цитируемой работе модульные праймеры составлялись из пред синтезированной библиотеки в тысячу 5-и 7-мерных олигонуклеотидов. Сложным нововведением явилось то, что для гептануклеотидных праймеров, предназначенных быть или средними, или задними блоками составного модульного праймера во время химического синтеза, специально добавлялась фосфатная групп к 3'-концу. Это исключало нежелательное построение цепи от этих неосновных модулей. Проблема выявления другого, вновь синтезированного фрагмента ДНК от среднего модуля, оказавшегося в силу каких-то причин крайним, не возникала при использовании в качестве метки радиоактивного фосфора на 5'-конце основного модуля. Однако при другом способе введения метки, в частности флуоресцентной метки для автоматического секвенирования, это приобретает серьезное значение. Следует отметить, что с целью уменьшения предсинтезированной библиотеки гептамеров (16384 или 47 теоретически возможных) два последних нуклеотида на 5'-конце синтезировались как вырожденные. Авторы данной статьи, исходя из своего опыта, отмечают, что неудачными праймерами оказываются те, которые характеризуются весьма низким GC-составом или в их состав входят модули, несущие только один G- или С-нуклеотиды или вообще не несущие оных, причем включая вырожденные участки, состоящие всего из одного или двух типов нуклеотидных оснований, не имеющие Pu/Pu-участков, образующих стэкинг-взаимодействия на границе 5-мерного переднего модуля и следующего за ним гептамерного. Таким образом, если исключить олигонуклеотидные модули с нежелательными параметрами, то библиотеки 5- и 7-меров могут быть ограничены по 500 вариантов для каждого типа праймеров.
Заинтересовавшись обнаруженным эффектом образования единственного уникального места отжига модульного праймера, тогда как используемые поодиночке составляющие его пентамерные и гексамерные праймеры образуют множественные участки праймирования, эта же группа авторов провела специальное исследование, направленное на выяснение механизмов этого процесса [Beskin et al., 1995]. Различные комбинации модульных и цельных праймеров с разным количеством фермента показали наличие эффекта конкуренции за "захват" молекулы фермента комплексами матрица-затравка, причем с заметным преимуществом более протяженных модулей. Практический вывод из результатов этой работы заключается в неиспользовании значительных количеств ДНК-полимеразы при секвенировании с помощью модульных праймеров, ввиду опасности образования множественных участков отжига и построения с них новых комплементарных цепей ДНК.
Значителен вклад российских ученых в разработку сегментированных праймеров для секвенирования ДНК праймерной "прогулкой". Свердловым и соавторами получены интересные результаты по секвенированию ДНК с помощью трех пентамерных праймеров, образующих последовательные дуплексы с матрицей ДНК [Ажикина и др., 19936; Azhikina et al., 1993]. Преимуществом использования библиотеки пентамерных праймеров для секвенирования ДНК праймерной "прогулкой" является довольно малый размер последней. Так, полная библиотека всех возможных пентануклеотидов состоит всего из 1024 (45) вариантов. Особенностью данных пентамеров (m5C)(m5C)(am2A)GT, G(am2A)(m5C)GG и (am2A)(am2A)(am2A)(am2A)(m5) (где m5C - 5-метилдезоксицитидин, am2A - 2-аминодезоксиаденозин) было то, что они содержали модифицированные цитозиновые и адениновые основания, что способствовало большей прочности образуемых дуплексов, как это было показано в их предыдущей работе [Ажикина и др., 1993а]. Исследованные температуры плавления (Tпл) дуплексов, образованных ДНК фага М13mp18, обычным 17-мерным праймером и двумя другими, характеризующимися разным набором модифицированных оснований, заметно различались. Так, для модифицированного праймера 5'-CTAAAACGACGGCCAGT-3' Тпл была равна 68 °С, тогда как для несущего только модифицированные цитозины она была уже 73 °С и для полностью модифицированного данного праймера по всем цитозинам и аденинам одновременно Тпл составила 78 °С. Подобное увеличение Тпл происходит за счет того, что аминогруппа 2-аминодезоксиаденозина участвует в образовании третьей водородной связи в А-Т паре, тогда как при образовании двойной спирали дополнительная метальная группа 5-метилцитозина попадает в большую бороздку ДНК [Ажикина и др., 1993а]. Использование всех этих 17-мерных праймеров в секвенировании ДНК показало, что модифицированные праймеры приводят к образованию более сильных сигналов, что может иметь важное значение для экономии реагентов. Было также выявлено, что степень модификации праймеров прямо коррелирует с величиной сигнала на рентгеновской пленке [Ажикина и др., 1993а].
Анализ различных факторов, влияющих на эффективность праймирования ДНК короткими модифицированными праймерами, расположенными встык на матрице ДНК, показал, что наиболее критичным является прочность связывания сегмента, расположенного на 3'-конце [Azhikina et al., 1996]. Этой же группой авторов проведено исследование особенностей распределения гексануклеотидов вдоль матрицы ДНК с помощью электронного микроскопа [Lagutina et al., 1996]. Ранее ими же была предложена схема взаимодействия матрицы, затравочной молекулы и ДНК-полимеразы, заключающаяся в том, что сама молекула фермента выполняет активную роль в образовании данного комплекса [Ажикина и др., 19936]. Так, в цитируемой работе авторы предположили, что стабильность инициирующего комплекса формируется как взаимодействием затравки с матрицей, так и вкладом самой ДНК-полимеразы, причем для разных ДНК-полимераз он может различаться, оставаясь при этом весьма значительным.
Еще более короткие блоки, состоящие из модифицированных тетрануклеотидов, были применены Кнорре и соавт. в качестве сегментированных праймеров для секвенирования ДНК [Кнорре и др., 1996]. Проведенное ими исследование эффективности праймирования такими составными праймерами из четырех модифицированных феназинием тетрануклеотидных блоков показало в отдельных случаях результаты, сравнимые с таковыми при использовании стандартного универсального праймера. Причем наилучшие результаты были получены с праймером, у которого только два блока из четырех несли производные феназиния 5'-PhnGTAA PhnAACG ACGG CCAG-3'. Следует отметить, что данный составной прай-мер является укороченным (на один нуклеотид) вариантом 17-мерного универсального праймера. Продемонстрированная возможность использования таких коротких модифицированных модулей в качестве секвенирующих праймеров позволяет создать относительно небольшую библиотеку предсинтезированных олигонуклеотидов, состоящую всего из 256 (44) вариантов, причем феназиниевые производные тех или иных тетрамеров, не зависящие от их последовательности, могут готовиться по мере надобности. Этим данный подход обеспечивает дополнительное преимущество перед модифицированными пентамерами, полученными Ажикиной и соавт. [Ажикина и др., 19936; Azhikina et al, 1993], поскольку последние (пента-меры) могут нести только модифицированные аденины и цитозины.
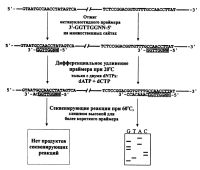
Интересным подходом к секвенированию ДНК праймерной "прогулкой" является способ ферментативного дифференциального удлинения короткого праймера с помощью неполного набора дезоксинуклеотид-трифосфатов, получившего наименование DENS (Differential Extension with Nucleotide Subsets) [Raja et al., 1997a]. Сущность данного способа заключается в том, что октануклеотидный праймер отжигается на предполагаемой к секвенированию матрице ДНК сразу в нескольких местах, но в результате ограниченного построения новой цепи только в тех местах, где на матрице будут находиться нуклеотиды комплементарные добавленным в реакционную смесь дезоксинуклеотидтрифосфатам, будет происходить удлинение праймера. Следующий этап проведения терминирующих реакций при повышенной температуре (60 °С) приведет к диссоциации с матрицы неудлиненных 8-мерных праймеров и, таким образом, при построении новой цепи множественных вновь синтезированных фрагментов ДНК образовываться не будет (рис.).
Важность DENS-механизма праймирования заключается в том, что октануклеотидные праймеры служат гораздо лучшей затравкой, чем любые более короткие модульные праймеры. Хотя, как отмечают авторы, DENS-механизм праймирования в сочетании с гептамерными модульными праймерами дает еще лучший эффект (естественно, первым праймером на 3'-конце служит октануклеотидный). Все же полная библиотека октануклеотидных праймеров слишком велика (65536 или 48) и авторами предложено использовать октануклеотидные праймеры с двумя полностью вырожденными нуклеотидами на 5'-конце, что позволяет резко ограничить число возможных вариантов данных октануклеотидов [Raja et al., 1997a]. Авторы считают, что вероятность наличия второго дополнительного сайта отжига данного праймера, где он также будет удлинен в ферментативной реакции хотя бы на 5 нуклеотидов (что может оказаться достаточным для дальнейшего праймирования при высокой температуре) весьма низка и составляет для клонированных в плазмидах фрагментов ДНК длиной 7-10 тпн всего около 10%. Что касается векторной молекулы, то зная ее последовательность, такую возможность множественного праймирования с ней можно исключить, так как при секвенировании ДНК праймерной "прогулкой" обычно существует достаточно большой выбор участков среди уже секвенированной ДНК в качестве дальнейших праймеров с отличающейся последовательностью для удлинения самого праймера этим способом. Другой возможностью является выбор той или иной смеси дезоксинуклеотидтрифосфатов (А + С; А + G; А + Т; С + G; С + Т и G + Т), наиболее оптимально подходящих к каждому конкретному случаю. Еще одним приложением DENS-механизма удлинения праймеров является возможность использования коротких 8-мерных олигонуклеотидов в циклическом секвенировании, где только на втором этапе используется термостабильная ДНК-полимераза [Raja et al., 1997a]. Подобное применение обычных модульных праймеров в циклическом секвенировании невозможно из-за их преждевременной диссоциации с матрицы ДНК при повышении температуры.
Отдельную группу затравочных молекул представляют собой так называемые вырожденные праймеры, составленные или на основе известного участка аминокислотной последовательности какого-либо белка, или на основе относительно консервативной последовательности нуклеотидов какого-либо гена из мультигенного семейства или ортологичного гена. В качестве примера можно привести некий условный участок аминокислотной последовательности Asp Gin Glu His Lys и соответствующий ему вырожденный праймер GAY-CAR-GAR-CAY-AAR. Показано эффективное использование подобных праймеров для скрининга бактериальных колоний на предмет конкретных вставок и их последующее секвенирование [Nichols, Dixon, 1988; Javed, Joshi, 1990]. Известно, что разные аминокислоты кодируются неодинаковым числом триплетов и поэтому для выбора подобных праймеров необходимо стремиться выбирать такие блоки аминокислот, для которых будет характерна минимальная вырожденность. Однако в случае неизбежного присутствия в выбранном участке аминокислот, кодируемых большим числом триплетов, такой праймер будет представлять собой весьма гетерогенную смесь олигонуклеотидов. Применение остатков инозина, образующего комплементарные пары с любым из четырех дезоксинуклеотидов, в вырожденных местах таких праймеров в значительной степени решает эту проблему [Knoth et al., 1988]. Использование таких праймеров с инозином вместо вариабельных нуклеотидов показало их высокую пригодность для секвенирования ДНК [Shen et al., 1993, 1996]. Сообщается также о синтезе праймеров для секвенирования ДНК и ПЦР, содержащих или 3-нитропиррол, или 5-нитроиндол в качестве универсальных оснований [Loakes et al., 1995].
Как уже отмечалось выше, для успешного секвенирования ДНК ферментативным методом необходимо осуществить отжиг затравочной молекулы на матрице ДНК в строго определенном месте. Последнее достигается как правильным подбором последовательности самого праймера, точного его синтеза и последующей очистки (если необходимо), так и определенной температурой отжига. В ранних рекомендациях предлагалось смесь одноцепочечной ДНК и двуцепочечного (биологического) праймера подвергать кипячению в течение 3 мин и затем выдерживать при температуре 65°С в течение 60-120 мин. Более короткие синтетические праймеры отжигали на матрице ДНК в течение 30-60 мин при температуре около 55°-65°С. Позднее стал применяться подход с постепенным понижением температуры отжига посредством помещения пробирки с матрицей ДНК и специфическим праймером в стакан с водой (100-150 мл), нагретой до 65°С, давая ей возможность произвольно остыть до 30°С. Отжиг более коротких (8-12 мерных), а также сегментированных или модульных праймеров требует понижения температуры даже до 3°-5°С.
Завершая рассмотрение различных олигонуклеотидных праймеров, следует упомянуть о предъявляемых требованиях к их качеству. Праймеры являются довольно критичным компонентом секвенирующих реакций. Как уже отмечалось выше, "читабельность" радиоавтографа геля или однозначность результатов, получаемых в автоматическом секвесторе ДНК, будет зависеть от гомогенности 5' -конца праймера. Поскольку при химическом синтезе олигонуклеотидов, начинающегося с 3*-конца, эффективность каждой реакции присоединения очередного звена никогда не составляет 100%, то неочищенный продукт будет представлять собой смесь основного продукта и более коротких олигонуклеотидов. Легко подсчитать, что чем длиннее будет синтезируемый олигонуклеотид, тем ниже содержание основного продукта. В связи с этим очищенные праймеры будут давать более лучшие результаты, но очистка праймеров требует дополнительных усилий и значительно увеличивает их стоимость. Что касается коротких модульных праймеров (5-, 6-, 7- или 8-меров) то они, как правило, используются в неочищенном виде [Burbelo, Iadarola, 1994; Slightom et al., 1994; Kaczorowski, Szybalski, 1996a] по причине довольно высокого содержания основного продукта. Имеются специальные работы, посвященные определению возможности использования неочищенных праймеров как в ручном, так и в автоматическом режимах. Так, было показано, что при эффективности реакции присоединения при синтезе праймеров более чем 98% очистка праймеров становится необязательной [Sanchez-Pescador, Urdea, 1984]. Проведенное детальное исследование большого числа олигонуклеотидных праймеров длиной 25 и 50 звеньев, синтезированных на различных приборах разными операторами, позволило выявить интересные факты [Pon et al., 1996]. Так, было показано, что при эффективности реакции присоединения свыше 98,5% очистки даже таких протяженных праймеров (25-меров) для целей секвенирования не требуется. В то же время, несмотря на то, что производителями синтезаторов и реагентов для синтеза ДНК гарантируется эффективность присоединения не ниже 98%, отмечаются и более низкие эффективности синтеза, получающиеся как за счет низкого качества реагентов, проблем с самими инструментами, так и ошибок персонала, приводящие к получению праймеров с выходом основного продукта 70% и менее. Весьма удивительным оказалось то, что даже такие праймеры показали вполне приемлемые для чтения секвенирующего геля результаты [Pon et al., 1996]. Это можно объяснить только тем, что вклад в гетерогенность получаемых полос ДНК при использовании неудовлетворительных праймеров вносит тот олигонуклеотид, который короче, чем основной продукт, всего лишь на одно-два звена, тогда как другие, более короткие, возможно, диссоциируют с матрицы ДНК на этапе построения новой цепи.
Одним из способов выявления гетерогенности синтезированных нуклеотидов может служить их разделение в денатурирующем высокопроцентном (12-20%) полиакриламидном геле после мечения по 5'-концу радиоактивным фосфором с помощью полинуклеотидкиназы фага Т4. Существует также возможность анализа праймеров без применения радиоактивной метки тонкослойной хроматографией на силикагеле и наблюдения их в ультрафиолетовом свете [Ansorge et al., 1996]. В исключительных случаях можно рекомендовать определение нуклеотидной последовательности самого праймера методом химической деградации в модификации Данилюка и соавт. [Данилюк и др., 1986].
Автоматический синтез олигодезоксирибонуклеотидов в настоящее время осуществляется с помощью специальных приборов - ДНК-синтезаторов как фосфитамидным [Beaucage, Caruthers, 1981], так и Н-фосфонатным [Froehler, Matteucci, 1986; Froehler et al., 1986] методами, пришедшими на смену используемым ранее фосфотриэфирному методу [Gait et al., 1980] и еще более давнему фосфодиэфирному [Gait, Sheppard, 1977]. Оба современных метода легко масштабируемы и обеспечивают высококачественный скоростной синтез (суммарное усредненное время одного цикла синтеза составляет 40-45 с для Н-фосфонатного метода и от 3 до 4,5 мин для фосфитамидного). Выбор того или иного метода не диктуется синтезатором ДНК, поскольку доступные ныне из коммерческих источников приборы позволяют осуществлять синтез олигонуклеотидов любым из этих методов. Справедливости ради следует отметить, что Н-фосфонатный метод синтеза дает несколько большее число ошибок при синтезе, чем фосфитамидный. Проведенное секвенирование различных праймеров общим количеством 8937 нуклеотидов, синтезированных Н-фосфонатным методом, выявило 37 ошибок или в среднем 1 на 241 нуклеотид [Vasser et al., 1990]. Ошибки по типу распределились следующим образом: 20 делеций, 12 вставок и только 2 замены. Однако в данной работе осуществлялось клонирование и секвенирование преимущественно протяженных олигонуклеотидов, имеющих в длину до 85 звеньев, а, как известно, с увеличением длины олигомера эффективность и точность синтеза снижаются. В то же время при секвенировании двадцати клонов, содержащих два более коротких олигонуклеотида (31- и 36-меры), было выявлено значительное число ошибок, составившее 4 на 680. Схожая работа была проведена и с олигонуклеотидами, синтезированными фосфитамидным методом [McClain et al., 1986]. Для секвенированных олигонуклеотидов общим количеством 3152 звена было выявлено 10 ошибок, часть которых представляла собой инсерции, делеций и замены нуклеотидов, и последних было все же несколько больше, чем для праймеров, синтезированных Н-фосфонатным методом. Среднее число ошибок составило одну на 315 нуклеотидов. Также различные типы ошибок выявлены при секвенировании 249 звеньев с целью анализа точности синтеза данных олигонуклеотидов фосфитамидным методом [Hecker, Rill, 1998].
Многие приборы позволяют осуществлять различный масштаб синтеза олигонуклеотидов, варьирующий обычно от 0,05 до 5 или даже 10 мкмоль. Крупные масштабы синтеза применяются при синтезе праймеров для диагностических целей. Для секвенирования же ДНК масштаб синтеза в 0,05 мкмоль часто оказывается избыточным. В связи с этим был разработан мультиплексный ДНК-синтезатор, позволяющий в автоматическом режиме осуществлять одновременный синтез 96 независимых образцов в полипропиленовом микропланшете с масштабом синтеза всего 0,02 мкмоль или 20 нмоль, что позволило резко снизить стоимость получаемых олигонуклеотидов [Lashkari et al., 1995]. Одновременный синтез 10 независимых образцов позволяет производить EMBL ДНК-синтезатор, характеризующийся к тому же экономным расходованием реактивов [Ansorge et al., 1996].
Видимо, здесь, в этом разделе, будет целесообразным упомянуть об относительно недорогом отечественном синтезаторе ДНК ASM-102U, выпускаемым ТОО "БИОССЕТ" (Новосибирск), который вполне способен обеспечить олигонуклеотидными праймерами для секвенирования ДНК и проведения ПЦР любую лабораторию. Однако в настоящее время весьма развит так называемый заказной синтез олигонуклеотидов, включая синтез модифицированных олигонуклеотидных праймеров, несущих какие-либо функциональные группы, что является дешевой альтернативой собственному синтезатору ДНК. Более подробную информацию о синтезаторе ДНК ASM-102U, а также о фирмах, занятых в заказном синтезе олигонуклеотидов, заинтересованный читатель может найти в разделе Отечественные поставщики материалов и оборудования для секвенирования ДНК.
В заключение данного раздела, видимо, стоит упомянуть о химерных олигонуклеотидах, так называемых PNA (Peptide Nucleic Acids), где скелет такой молекулы образуется благодаря наличию N-(2-aMHHO-этил)глициновых остатков и фосфодиэфирные связи между азотистыми основаниями таким образом заменены амидными. Синтезированные достаточно давно [Nielsen et al., 1991], они уже нашли весьма широкое применение в молекулярной биологии и биотехнологии [Buchardt et al., 1993 Corey, 1997; Uhlmann, 1998], поскольку оказались способными формировать двойную спираль с комплементарными им обычными олигонуклеотидами, образуя Уотсон-Криковские пары [Egholm et al., 1993; Wittung et al., 1994]. Однако до последнего времени в литературе не встречалось сообщений об использовании таких PNA в качестве затравочных молекул для ДНК-полимераз. В недавней работе американских авторов была показана принципиальная возможность использования подобных несколько модифицированных PNA в качестве праймера для разных полимераз, включая Кленовский фрагмент ДНК-полимеразы I [Misra et al., 1998]. Так, первые 19 азотистых оснований этой химеры являлись PNA, тогда как 3'-конец этой молекулы был представлен обычным динуклеотидом со свободной ОН-группой в 3'-положении дезоксирибозы. Удлинение данного праймера сопровождалось включением радиоактивно меченного дЦТФ, приводя к образованию меченых продуктов. Возможность применения подобных праймеров для практических целей в виде затравочных молекул для секвенирования ДНК выглядит несколько проблематично ввиду чрезвычайно прочного связывания PNA с ДНК-матрицей [Cherny et al., 1993]. Однако продолжающийся синтез различным образом модифицированных PNA [Efimov et al., 1998], может быть, со временем решит эту проблему. Некоторым преимуществом подобных затравочных молекул перед обычными оли-гонуклеотидными праймерами является их устойчивость к действию различных нуклеаз, что может позволить использовать химерные PNA-праймеры с различными ДНК-полимеразами, обладающими по крайней мере 5' → 3'-экзонуклеазной активностью. В то же время, исходя из позиций сегодняшнего дня, это не представляется очень актуальным.
| "ЭБНБ" >> "З" >> "ЗА" >> "ЗАТ" |
Статья про "Затравочные молекулы для пцр" в Энциклопедии БНБ была прочитана 9310 раз
| Пицца в сковороде |
| Морской Гребешок в беконе |
TOP 15
- Вши и борьба с ними
- Пижма обыкновенная
- Каштан конский обыкновенный
- Роль элементов в жизни растений
- Пшеница
- Иван-чай узколистный
- Календула лекарственная
- Обеззараживание химическими средствами
- Клевер луговой
- Дезинфекция текущая
- Душица обыкновенная
- Бессмертник песчаный
- Как устроены растения
- Морфологические признаки почвы
- Хвощ полевой