


БНБ
"ЭБНБ" (14252)
- Photogallery
- Естественные науки - Математика - Технология
- Авиация и машиностроение
- Высокие технологии
- Вычислительная техника
- Нанотехнология
- Роботехника
- Энергетика
- Электроника
Матрицы для секвенирования днк по сэнгеру
Определение "Матрицы для секвенирования днк по сэнгеру" в ЭБНБ
 |
| Получение одноцепочечной матрицы ДНК |
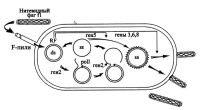 |
| Жизненный цикл нитевидного одноцепочечного фага f1 |
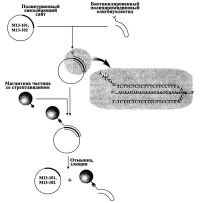 |
| Выделение и очистка одноцепочечной ДНК |
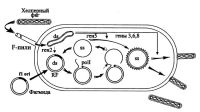 |
| Схема получения одноцепочечной ДНК |
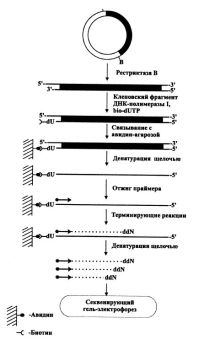 |
| Схема твердофазного секвенирования ДНК |
 |
| Секвенирование двуцепочечной матрицы ДНК |
Фаговые частицы векторов содержат одноцепочечную ДНК протяженностью около 7 тысяч нуклеотидов, покрытую фаговыми белками. Белковая оболочка фага состоит из основного белка, представленного 2700 копиями (для дикого фага) и кодируемого геном pVIII фага. Остальные белки оболочки pIII, pIV, pVII и рIХ относятся к минорным белкам и представлены 5 копиями каждый. Эти белки расположены на концах вариона и отвечают за заражение клетки Е. Coli и за выход созревших фаговых частиц наружу (рис.). Заинтересованный читатель может почерпнуть более подробную информацию об особенностях организации одноцепочечных нитевидных фагов и их жизненном цикле из обзорных статей [Смит, 1991; Messing, 1983]. Краткая история создания векторов на основе фага М13 изложена в обзорной статье Месссинга [Messing, 1991].
Фаги f1, будучи не изометрическими, позволяют клонировать в них вставки чужеродной ДНК, однако их размер обычно не превышает 1 тпн ввиду нестабильности вставок большего размера. Созревание фаговых частиц сопровождается их выходом наружу в культуральную среду без лизиса бактериальной клетки. Поскольку ДНК в фаговых частицах представлена одиночной (+)-цепью, то и содержащаяся в рекомбинантных фагах вставка также будет одноцепочечной. Остается только собрать фаговые частицы и отделить от белка фаговую ДНК. После завершения этих процедур одноцепочечная матрица ДНК готова для секвенирования ферментативным методом. Детальное описание всего этого процесса изложено в многочисленных статьях [Messing et al., 1981; Messing, 1983; Sangeret al., 1980; Davies, 1982; Bankier, Barrell, 1983, 1989; Kristensen et al., 1987; Краев, 1988] и практических руководствах [Маниатис и др., 1984; Sambrook et al., 1989; Promega Guide, 1996]. Кроме этого, существует описание отдельных подходов, имеющих целью как-то усовершенствовать процедуры выращивания фага М13, выделения и очистки его одноцепочечной ДНК [Reddy, McKenney, 1996]. Довольно много статей посвящено автоматизации процесса выделения одноцепочечной ДНК фага М13 из большого числа фаговых бляшек, что имеет прямое отношение к автоматическим методам секвенирования ДНК и поэтому будет рассмотрено в соответствующем разделе.
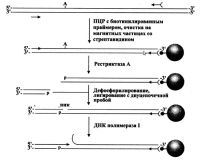
Среди других подходов отметим предложенный оригинальный метод выделения и очистки одноцепочечной ДНК фага М13, основанный на аффинном захвате специальным образом модифицированных векторов Ml3-101 и Ml3-102, путем образования трехцепочечных гибридных конструкций [Johnson et al., 1996; Chen et al., 1996]. Данные вектора несут полипуриновый блок из двадцати нуклеотидов, который образовывает трехцепочечную структуру с дважды комплементарным ему (т.е. несущим два гомологических участка) 50-звенным полипиримидиновым олигонуклеотидом, и поскольку этот последний олигонуклеотид биотинилирован, то имеется возможность сорбции всего этого "сэндвича" на магнитных частицах, покрытых стрептавидином. Показанный на рис. весь этот процесс был предназначен для сорбции фаговой ДНК из осветленной культуральной жидкости, удаления белков и элюции "чистой" ДНК, готовой для ферментативного секвенирования. Требующий специальных векторов, специальных биотинилированных олигонуклеотидов, причем довольно большого размера, магнитных частиц со стрептавидином этот метод никак не может быть универсальным, хотя авторы цитируемой работы говорят о возможности его масштабирования и пригодности для крупномасштабного секвенирования. Следует отметить, что подобный подход с формированием трехцепочечных структур и аффинного захвата был использован этими же авторами также и для выделения вставки из космидного клона с целью ее последующего секвенирования [Ji et al., 1994].
Последующие усовершенствования векторов для молекулярного клонирования, подробно рассмотренные в седьмой главе данной книги, привели к тому, чтобы были созданы фагмиды, представляющие собой химерные конструкции, являющиеся по сути плазмидами, но несущими участок одноцепочечного фага fl, ответственный за репликацию [Dente et al., 1984]. При обычном выращивании этих конструкций они реплицировались по типу плазмиды, но после добавления специального фага-помощника, называемого еще хелперным, они переходили в режим функционирования фага и секретировали наружу, кроме хелперного фага, еще и псевдофаговые частицы с (+)- или (-)-цепью ДНК (рис.). Упаковка той или иной цепи ДНК в фаговые частицы зависела от ориентации f1 ориджина репликации одноцепочечного фага. Дальнейшие процедуры по сбору псевдофаговых частиц и очистке одноцепочечной ДНК ничем не отличались от таковых при работе с настоящими одно-цепочечными фагами. В литературе встречаются упоминания о некоторых улучшениях выделения фагмидных ДНК как одноцепочечных матриц для секвенирования [Blondel, Thillet, 1991; Tang et al., 1996]. Интересна работа, в которой говорится о легко воспроизводимом методе получения одноцепочечной ДНК фагмид после трансформации ими компетентных клеток Е. Coli, уже содержащих хелперный фаг [Jupin, Gronenborn, 1995].
Несмотря на то, что с помощью фаговых или фагмидных векторов получение одноцепочечных молекул ДНК не представляло особых проблем, желание не тратить на очистку одноцепочечной ДНК от прочно связанных фаговых белков заставляло исследователей разрабатывать подходы к секвенированию двуцепочечных молекул ДНК, не останавливаясь даже перед фактом, что качество получаемых результатов при секвенировании двуцепочечной ДНК всегда заведомо хуже, чем одноцепочечной. (Здесь понятия "качество" секвенирования и "количество" определенных при этом нуклеотидов очень тесно связаны, поскольку при более высоком качестве полос на радиоавтографе секвенирующего геля "прочитать" можно будет гораздо большее их количество.) Так, не взирая на потенциально худшие результаты, большое число работ посвящено описанию различных подходов по подготовке двуцепочечных матриц ДНК, пригодных для ферментативного секвенирования дидезокси-методом. Такой, казалось бы, неразумный подход объясняется повышением общей производительности всего процесса секвенирования ДНК за счет экономии времени как на очистку одноцепочечных матриц ДНК, так и на проведение необходимого переклонирования вставки в специальный фаговый или фагмидный вектор.
Большое значение при таком секвенировании двуцепочечной ДНК приобретает качество выделенного препарата. И одним из главных требований является отсутствие как линейных форм плазмидной ДНК, так и релаксированных, несущих одиночные разрывы цепей ДНК -"ники". В противном случае значительное число новосинтезированных цепей ДНК может оказаться терминированными не специфически, а по причине разрывов цепи в исходной матрице ДНК. Высокую чистоту препаратов плазмидной ДНК, представленной в суперскрученной форме, обеспечивает метод ультрацентрифугирования в градиенте плотности хлористого цезия, широко использовавшийся в первое время [Маниатис и др., 1984; Sambrook et al., 1989]. Однако значительные усилия, затрачиваемые при очистке плазмидной ДНК с помощью ультрацентрифугирования в хлористом цезии, и все большее число плазмид, которые надо было секвенировать, заставляли исследователей разрабатывать новые, более быстрые, простые и дешевые подходы. Тем более что проведенные сравнительные исследования секвенирования двуцепочечных плазмидных ДНК, очищенных в градиенте плотности CsCl и выделенных мини-методом, показали сравнимое качество [Lim, Репе, 1988; Toneguzzo et aL, 1988; Zhang et al., 1988; Riley, 1989]. Весьма оригинален метод очистки плазмидной ДНК для ее дальнейшего секвенирования с использованием хлористого цезия и бромистого этидия, не требующий ультрацентрифугирования [Saunders, Burke, 1990]. Этот подход основан на факте образования агрегатов между полисахарами, белками и бромистым этидием в присутствии высокой концентрации CsCl, удаляемых в микроцентрифуге при 10000g. Авторы приводят результаты секвенирования одного и того же образца ДНК, выделенного классическим ультрацентрифугированием в градиенте плотности хлористого цезия и этим предложенным методом, причем сравнение оказывается даже в пользу последнего, что несколько удивляет.
В большинстве случаев выделения плазмидной ДНК для ее последующего секвенирования за основу был взят быстрый щелочной метод [Birnboim, Doly, 1979; Chen, Seeburg, 1985; Hattori, Sakaki, 1985; Kraft et al., 1988; Hisao, 1991, Xiang et al., 1994]. В одной работе было показано, что депротеинизация выделенной щелочным методом плазмидной ДНК кислым фенолом вместо обычно используемой смеси фенол-хлороформ, приводит к высокому качеству картины полос секвенирован-ной ДНК [Weikert, Chambliss, 1989]. В других работах [Murhy, Kavanagh, 1988; Wang et al, 1988; Jones, Schofield, 1990; Seto, 1990] применялся метод выделения ДНК плазмид кипячением [Holmes, Quigley, 1981]. Сообщается об использовании достаточного длительного метода выделения плазмидной ДНК мягким лизисом с помощью смеси слабых детергентов - бридж-58 и дезоксихолат натрия [Clewell, Helinski, 1969], показавшего при этом хорошее качество секвенирования [Lim, Репе, 1988]. В одной работе сообщается о быстром, также путем кипячения, "турбопреп" выделении плазмидных ДНК, использованных для последующего секвенирования без какой-либо дополнительной очистки [Woodford, Usdin, 1991]. Недавно предложен "турбопреп II", позволяющий с помощью кипячения осуществлять минивыделение большого количества образцов (до 1920 за 8 ч) плазмидной ДНК одним экспериментатором без использования приборов-автоматов [Konecki, Phillips, 1998]. Другая быстрая процедура выделения плазмидной ДНК, пригодной для ферментативного секвенирования, и проводимая всего в одной пробирке, основана на использовании в качестве осаждающего агента цетилтриметиламмониум бромида [Del Sal et al., 1988]. Сообщается об использовании ионообменной смолы Qiagen для быстрого выделения плазмидной ДНК [Zimmermann et al., 1990].
В большинстве упомянутых выше работ [Chen, Seeburg, 1985; Hattori, Sakaki, 1985; Kraft et al., 1988; Wang et al., 1988; Jones, Schofield, 1990; Seto, 1990; Hsiao, 1991, Woodford, Usdin, 1991; Xiang et al., 1994] одноцепочечные матрицы ДНК для секвенирования готовились путем щелочной денатурации уже выделенной плазмидной ДНК и некоторые различия заключались лишь в применяемых концентрациях щелочи и особенностях нейтрализации с помощью или HCl, или уксуснокислого аммония, или уксуснокислого натрия. Еще в одной работе щелочная денатурация при помощи 1М NaOH осуществлялась при повышенной (80°С) температуре в течение 5 мин и после снижения до 37°С проводили нейтрализацию 1М HCl [Zimmermann et al., 1990]. Такая же высокотемпературная щелочная денатурация плазмидной ДНК использовалась еще в одной работе [Martsen et al., 1990]. Другими авторами для удаления щелочи была применена ультрафильтрация в виде спин-диализа в микроцентрифуге [Murphy, Kavanagh, 1988]. Имеется сообщение о превращении суперскрученной формы ДНК плазмиды в одноцепочечную матрицу посредством тепловой денатурации [Agelon, Chen, 1986]. Несмотря на то что наличие в реакционной смеси молекул РНК не оказывает серьезного влияния на проведение терминирующих реакций, тем не менее их отсутствие может только улучшить качество секвенирования ДНК. Так, описан быстрый способ удаления большого количества загрязняющей РНК без использовании РНКазы, основанный на селективном осаждении молекул РНК высокой концентрацией (100 мМ) хлористого магния [Yamamoto, Horikoshi, 1995].
Помимо секвенирования вставок в плазмидных векторах таковое возможно и с другими векторными системами, и в литературе сообщается о быстрых и простых способах выделениях ДНК фага лямбда, пригодной для ее непосредственного двуцепочечного секвенирования ферментативным методом с использованием в качестве затравок стандартных олигонуклеотидных праймеров [Manfioletti, Schneider, 1988; Malik et al., 1990].
Был описан интересный способ получения одноцепочечной матрицы ДНК, легший позднее в основу такого высокопроизводительного метода как твердофазное секвенирование (рис.) [Stahl et al., 1988]. В цитируемой работе фрагмент ДНК, меченный биотином, сорбировался на твердой фазе в виде авидин-агарозы. После этапов денатурации щелочью и последующей отмывки на оставшейся одной цепи ДНК, связанной через биотин-авидиновый комплекс с агарозой, отжигался секвенирующий праймер и шло построение комплементарной цепи ДНК Кленовским фрагментом ДНК-полимеразы в условиях терминации. Затем еще один раунд щелочной денатурации приводил к высвобождению новосинтезиро-ванных цепей ДНК, пригодных для их разделения секвенирующим гель-электрофорезом. Справедливости ради следует отметить, что авторы в данной статье упоминают о принципиальной возможности повторения циклов отжига праймера и построения цепи по сорбированной матрице, что является, по сути, циклическим секвенированием ДНК.
Другой способ секвенирования двуцепочечной матрицы ДНК заключается в вытеснении одной цепи за счет самого фермента Кленовского фрагмента ДНК-полимеразы I, для которого характерна подобная активность [Fu et al., 1997]. С этой целью к определенному концу рестриктазного фрагмента ДНК (предварительно дефосфорилированного) присоединялся путем лигирования фосфорилированный двуцепочечный олигонуклеотидный "праймер". Образовавшийся в результате "ник" служил стартовой точкой для построения новой комплементарной цепи ДНК в условиях терминации, вытесняя ранее существующую цепь (рис.). Однако следует отметить, что количество определяемых нуклеотидов таким способом было невелико отчасти из-за низкой процессивности самой используемой ДНК-полимеразы и составляло всего около 50 нуклеотидов, впрочем добавление в реакционную смесь специфического к однонитевой ДНК SSB-белка позволило осуществить "чтение" уже 180 нуклеотидов.
С открытием процесса избирательной амплификации какого-либо фрагмента ДНК с помощью ПЦР и дальнейшего развития этого метода появилась возможность специально готовить двуцепочечные матрицы для секвенирования ДНК ферментативным методом. Причем, прибегая к некоторым ухищрениям, имеется возможность получать матрицы ДНК, или обогащенные по одной цепи, или содержащие только одну цепь.
| "ЭБНБ" >> "М" >> "МА" >> "МАТ" |
Статья про "Матрицы для секвенирования днк по сэнгеру" в Энциклопедии БНБ была прочитана 6105 раз
| Коптим скумбрию в коробке |
| Гороховое пюре |
TOP 15
- Вши и борьба с ними
- Пижма обыкновенная
- Каштан конский обыкновенный
- Роль элементов в жизни растений
- Пшеница
- Иван-чай узколистный
- Календула лекарственная
- Обеззараживание химическими средствами
- Клевер луговой
- Дезинфекция текущая
- Душица обыкновенная
- Бессмертник песчаный
- Как устроены растения
- Морфологические признаки почвы
- Хвощ полевой