


БНБ
"ЭБНБ" (14252)
- Photogallery
- Естественные науки - Математика - Технология
- Авиация и машиностроение
- Высокие технологии
- Вычислительная техника
- Нанотехнология
- Роботехника
- Энергетика
- Электроника
Принцип секвенирования днк по сэгнеру
Определение "Принцип секвенирования днк по сэгнеру" в ЭБНБ
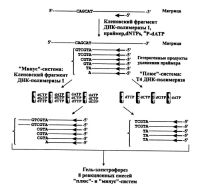 |
| Схема секвенирования ДНК "плюс-минус"-методом |
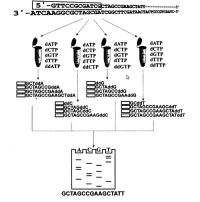 |
| Принцип сиквенирования ДНК по Сэгнеру |
В основе метода секвенирования ДНК, разработанного Сэнгером и соавт. [Sanger et al., 1977a], называемого также методом секвенирования путем терминации цепи, лежал принцип ферментативного построения комплементарной цепи ДНК по существующей одноцепочечной матрице при происходящем в разных местах цепи ДНК ингибировании ее дальнейшего роста.
Составляющими этого процесса являлись: одноцепочечная матрица ДНК; короткая затравочная молекула, комплементарная определенному участку матрицы; ДНК-полимераза (Кленовский фрагмент ДНК-полимеразы I E. Coli); 2'-дезоксинуклеотид 5'-трифосфаты (дАТФ, дГТФ, дТТФ, дЦТФ или просто дНТФ); 2',3'-дидезоксинуклеотид 5'-трифосфаты (ддАТФ, ддГТФ, ддТТФ, ддЦТФ или просто ддНТФ); реакционный буфер с ионами Mg2+.
Ключевым моментом этого процесса являлась терминация построения комплементарной цепи ДНК, происходящая при включении ДНК-полимеразой модифицированных аналогов природных субстратов диде-зоксинуклеотид трифосфатов, являющихся известными ингибиторами ДНК-полимеразы, как было ранее показано в случае с ддТТФ [Atkinson et al., 1969]. Отсутствие второго гидроксильного остатка в 3'-положении рибозного кольца у дидезоксипроизводных приводила к невозможности присоединения к ним следующего нуклеотида, и рост цепи таким образом прерывался. Такое терминирование происходило одновременно как бы в двух режимах - заданном и случайном. Заданность определялась тем, что в одной отдельной пробирке наряду со всеми четырьмя дНТФ (один из которых был радиоактивно меченным) присутствовал только один какой-нибудь конкретный ддНТФ, случайность же происходила от того, что включение данного ддНМФ в растущую цепь ДНК было произвольным, но, естественно, с учетом принципа комплементарности. То есть происходила некая конкуренция между дНТФ и ддНТФ при их выборе ДНК полимеразой. Поскольку в четырех реакционных пробирках (по типу оснований - А, С, G и Т) присутствовало огромное количество молекул секвенируемой ДНК, во много раз превосходящее ту длину фрагмента, которую могла построить ДНК-полимераза, то по теории вероятности каждое положение этого типа оснований во фрагменте ДНК оказывалось представленным соответствующим ддНМФ.
Другим ключевым моментом являлся гетерогенный размер полученных фрагментов ДНК. Их гетерогенность определялась тем, что все З'-концы фрагментов вновь синтезируемой цепи ДНК во всех четырех реакционных пробирках были терминированы соответствующими ддНМФ и, таким образом, представляли собой полный набор всех возможных длин в пределах секвенируемого участка, построенного ДНК-полимеразой. Что касается 5'-конца всех этих фрагментов ДНК, принадлежащих новой цепи, то он должен быть для всех фрагментов строго одинаковым и принадлежать 5'-концу исходной затравочной молекулы.
Продукты реакций терминирования подвергались денатурации и уже одноцепочечные меченые фрагменты, имевшие гомогенный 5'-конец и гетерогенные З'-концы, разделялись по длине высоковольтным электрофорезом высокого разрешения в полиакриламидном геле, позволяющим разделять фрагменты ДНК, отличающиеся всего на один нуклеотид, в четырех соседних дорожках, соответствующих специфическим терминирующим реакциям, например в последовательности Т, С, G, А. По завершению электрофореза гель экспонировался на рентгеновскую пленку и по прошествии некоторого времени (обычно от одних до двух суток) с проявленной пленки можно было "читать" последовательность нуклеотидов секвенируемого участка ДНК, начиная с нижней части геля и последовательно поднимаясь вверх по этим четырем дорожкам, соответствующим одному фрагменту ДНК.
Выше на рис. схематично показан весь описанный выше процесс, но следует отметить, что он несколько идеализирован. При его выполнении экспериментаторов подстерегает множество нюансов, которые могут свести на нет все предварительные усилия. Так, и подготовка самой матрицы к секвенированию, и выбор затравочной молекулы, и определенное соотношение дНТФ/ддНТФ, зависящее, главным образом, от используемой ДНК-полимеразы, и мечение вновь синтезируемой цепи ДНК, и параметры секвенирующего геля, и даже особенности радиоавтографии зависят от конкретных задач и требуют тщательного исполнения.
| "ЭБНБ" >> "П" >> "ПР" >> "ПРИ" |
Статья про "Принцип секвенирования днк по сэгнеру" в Энциклопедии БНБ была прочитана 14365 раз
| Коптим скумбрию в коробке |
| Панайпай |
TOP 15
- Вши и борьба с ними
- Пижма обыкновенная
- Каштан конский обыкновенный
- Роль элементов в жизни растений
- Пшеница
- Иван-чай узколистный
- Календула лекарственная
- Обеззараживание химическими средствами
- Клевер луговой
- Дезинфекция текущая
- Душица обыкновенная
- Бессмертник песчаный
- Как устроены растения
- Хвощ полевой
- Морфологические признаки почвы